+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cytoplasmic dynein-1 A1/A2 motor domains bound to LIS1 | ||||||||||||
 マップデータ マップデータ | |||||||||||||
 試料 試料 |
| ||||||||||||
 キーワード キーワード |  Dynein (ダイニン) / Dynein (ダイニン) /  AAA-Atpase / AAA-Atpase /  LIS1 / LIS1 /  MOTOR PROTEIN (モータータンパク質) MOTOR PROTEIN (モータータンパク質) | ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報 Regulation of PLK1 Activity at G2/M Transition / Loss of Nlp from mitotic centrosomes / Recruitment of mitotic centrosome proteins and complexes / Loss of proteins required for interphase microtubule organization from the centrosome / Anchoring of the basal body to the plasma membrane / AURKA Activation by TPX2 / corpus callosum morphogenesis / establishment of planar polarity of embryonic epithelium / microtubule cytoskeleton organization involved in establishment of planar polarity / ameboidal-type cell migration ... Regulation of PLK1 Activity at G2/M Transition / Loss of Nlp from mitotic centrosomes / Recruitment of mitotic centrosome proteins and complexes / Loss of proteins required for interphase microtubule organization from the centrosome / Anchoring of the basal body to the plasma membrane / AURKA Activation by TPX2 / corpus callosum morphogenesis / establishment of planar polarity of embryonic epithelium / microtubule cytoskeleton organization involved in establishment of planar polarity / ameboidal-type cell migration ... Regulation of PLK1 Activity at G2/M Transition / Loss of Nlp from mitotic centrosomes / Recruitment of mitotic centrosome proteins and complexes / Loss of proteins required for interphase microtubule organization from the centrosome / Anchoring of the basal body to the plasma membrane / AURKA Activation by TPX2 / corpus callosum morphogenesis / establishment of planar polarity of embryonic epithelium / microtubule cytoskeleton organization involved in establishment of planar polarity / ameboidal-type cell migration / interneuron migration / Regulation of PLK1 Activity at G2/M Transition / Loss of Nlp from mitotic centrosomes / Recruitment of mitotic centrosome proteins and complexes / Loss of proteins required for interphase microtubule organization from the centrosome / Anchoring of the basal body to the plasma membrane / AURKA Activation by TPX2 / corpus callosum morphogenesis / establishment of planar polarity of embryonic epithelium / microtubule cytoskeleton organization involved in establishment of planar polarity / ameboidal-type cell migration / interneuron migration /  1-alkyl-2-acetylglycerophosphocholine esterase complex / positive regulation of neuromuscular junction development / centriolar subdistal appendage / maintenance of centrosome location / microtubule sliding / centriole-centriole cohesion / transport along microtubule / platelet activating factor metabolic process / dynein light chain binding / ventral spinal cord development / microtubule anchoring at centrosome / 1-alkyl-2-acetylglycerophosphocholine esterase complex / positive regulation of neuromuscular junction development / centriolar subdistal appendage / maintenance of centrosome location / microtubule sliding / centriole-centriole cohesion / transport along microtubule / platelet activating factor metabolic process / dynein light chain binding / ventral spinal cord development / microtubule anchoring at centrosome /  acrosome assembly / radial glia-guided pyramidal neuron migration / microtubule organizing center organization / cerebral cortex neuron differentiation / dynein heavy chain binding / positive regulation of intracellular transport / central region of growth cone / positive regulation of embryonic development / reelin-mediated signaling pathway / regulation of metaphase plate congression / establishment of centrosome localization / positive regulation of cytokine-mediated signaling pathway / cortical microtubule organization / establishment of spindle localization / melanosome transport / astral microtubule / positive regulation of spindle assembly / layer formation in cerebral cortex / acrosome assembly / radial glia-guided pyramidal neuron migration / microtubule organizing center organization / cerebral cortex neuron differentiation / dynein heavy chain binding / positive regulation of intracellular transport / central region of growth cone / positive regulation of embryonic development / reelin-mediated signaling pathway / regulation of metaphase plate congression / establishment of centrosome localization / positive regulation of cytokine-mediated signaling pathway / cortical microtubule organization / establishment of spindle localization / melanosome transport / astral microtubule / positive regulation of spindle assembly / layer formation in cerebral cortex /  retromer complex / nuclear membrane disassembly / auditory receptor cell development / microtubule plus-end / positive regulation of dendritic spine morphogenesis / vesicle transport along microtubule / positive regulation of microtubule nucleation / stem cell division / stereocilium / myeloid leukocyte migration / retromer complex / nuclear membrane disassembly / auditory receptor cell development / microtubule plus-end / positive regulation of dendritic spine morphogenesis / vesicle transport along microtubule / positive regulation of microtubule nucleation / stem cell division / stereocilium / myeloid leukocyte migration /  P-body assembly / P-body assembly /  dynein complex / COPI-independent Golgi-to-ER retrograde traffic / microtubule plus-end binding / minus-end-directed microtubule motor activity / dynein complex / COPI-independent Golgi-to-ER retrograde traffic / microtubule plus-end binding / minus-end-directed microtubule motor activity /  cytoplasmic dynein complex / retrograde axonal transport / negative regulation of JNK cascade / non-motile cilium assembly / dynein light intermediate chain binding / brain morphogenesis / Recruitment of NuMA to mitotic centrosomes / cytoplasmic dynein complex / retrograde axonal transport / negative regulation of JNK cascade / non-motile cilium assembly / dynein light intermediate chain binding / brain morphogenesis / Recruitment of NuMA to mitotic centrosomes /  繊毛 / HSP90 chaperone cycle for steroid hormone receptors (SHR) in the presence of ligand / COPI-independent Golgi-to-ER retrograde traffic / MHC class II antigen presentation / 繊毛 / HSP90 chaperone cycle for steroid hormone receptors (SHR) in the presence of ligand / COPI-independent Golgi-to-ER retrograde traffic / MHC class II antigen presentation /  retrograde transport, endosome to Golgi / nuclear migration / osteoclast development / COPI-mediated anterograde transport / microtubule associated complex / retrograde transport, endosome to Golgi / nuclear migration / osteoclast development / COPI-mediated anterograde transport / microtubule associated complex /  motor behavior / neuromuscular process / motor behavior / neuromuscular process /  kinesin complex / kinesin complex /  microtubule motor activity / dynein intermediate chain binding / dynein complex binding / neuromuscular junction development / microtubule motor activity / dynein intermediate chain binding / dynein complex binding / neuromuscular junction development /  細胞結合 / cochlea development / microtubule-based movement / transmission of nerve impulse / cell leading edge / germ cell development / 細胞結合 / cochlea development / microtubule-based movement / transmission of nerve impulse / cell leading edge / germ cell development /  dynactin binding / establishment of mitotic spindle orientation / dynactin binding / establishment of mitotic spindle orientation /  phospholipase binding / neuromuscular process controlling balance / neuroblast proliferation / phospholipase binding / neuromuscular process controlling balance / neuroblast proliferation /  protein secretion / positive regulation of axon extension / Amplification of signal from unattached kinetochores via a MAD2 inhibitory signal / cytoplasmic microtubule / microtubule-based process / COPI-mediated anterograde transport / lipid catabolic process / regulation of microtubule cytoskeleton organization / cytoplasmic microtubule organization / protein secretion / positive regulation of axon extension / Amplification of signal from unattached kinetochores via a MAD2 inhibitory signal / cytoplasmic microtubule / microtubule-based process / COPI-mediated anterograde transport / lipid catabolic process / regulation of microtubule cytoskeleton organization / cytoplasmic microtubule organization /  stress granule assembly / Mitotic Prometaphase stress granule assembly / Mitotic Prometaphase類似検索 - 分子機能 | ||||||||||||
| 生物種 |   Homo sapiens (ヒト) / Homo sapiens (ヒト) /   Sus scrofa (ブタ) Sus scrofa (ブタ) | ||||||||||||
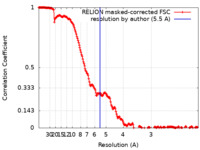
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 5.5 Å クライオ電子顕微鏡法 / 解像度: 5.5 Å | ||||||||||||
 データ登録者 データ登録者 | Singh K / Lau CK / Manigrasso G / Gassmann R / Carter AP | ||||||||||||
| 資金援助 |  英国, European Union, 3件 英国, European Union, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: Science / 年: 2024 ジャーナル: Science / 年: 2024タイトル: Molecular mechanism of dynein-dynactin complex assembly by LIS1. 著者: Kashish Singh / Clinton K Lau / Giulia Manigrasso / José B Gama / Reto Gassmann / Andrew P Carter /   要旨: Cytoplasmic dynein is a microtubule motor vital for cellular organization and division. It functions as a ~4-megadalton complex containing its cofactor dynactin and a cargo-specific coiled-coil ...Cytoplasmic dynein is a microtubule motor vital for cellular organization and division. It functions as a ~4-megadalton complex containing its cofactor dynactin and a cargo-specific coiled-coil adaptor. However, how dynein and dynactin recognize diverse adaptors, how they interact with each other during complex formation, and the role of critical regulators such as lissencephaly-1 (LIS1) protein (LIS1) remain unclear. In this study, we determined the cryo-electron microscopy structure of dynein-dynactin on microtubules with LIS1 and the lysosomal adaptor JIP3. This structure reveals the molecular basis of interactions occurring during dynein activation. We show how JIP3 activates dynein despite its atypical architecture. Unexpectedly, LIS1 binds dynactin's p150 subunit, tethering it along the length of dynein. Our data suggest that LIS1 and p150 constrain dynein-dynactin to ensure efficient complex formation. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_17829.map.gz emd_17829.map.gz | 165.1 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-17829-v30.xml emd-17829-v30.xml emd-17829.xml emd-17829.xml | 27.2 KB 27.2 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_17829_fsc.xml emd_17829_fsc.xml | 19.2 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_17829.png emd_17829.png | 55.7 KB | ||
| マスクデータ |  emd_17829_msk_1.map emd_17829_msk_1.map | 178 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-17829.cif.gz emd-17829.cif.gz | 10.7 KB | ||
| その他 |  emd_17829_additional_1.map.gz emd_17829_additional_1.map.gz emd_17829_half_map_1.map.gz emd_17829_half_map_1.map.gz emd_17829_half_map_2.map.gz emd_17829_half_map_2.map.gz | 164.7 MB 164.8 MB 164.8 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-17829 http://ftp.pdbj.org/pub/emdb/structures/EMD-17829 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-17829 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-17829 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8pqzMC  8pqvC  8pqwC  8pqyC  8pr0C  8pr1C  8pr2C  8pr3C  8pr4C  8pr5C  8ptkC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_17829.map.gz / 形式: CCP4 / 大きさ: 178 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_17829.map.gz / 形式: CCP4 / 大きさ: 178 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.059 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_17829_msk_1.map emd_17829_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-追加マップ: unsharpened map
| ファイル | emd_17829_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | unsharpened map | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_17829_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_17829_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Cytoplasmic dynein-A1/A2 motor domains bound to LIS1
| 全体 | 名称: Cytoplasmic dynein-A1/A2 motor domains bound to LIS1 |
|---|---|
| 要素 |
|
-超分子 #1: Cytoplasmic dynein-A1/A2 motor domains bound to LIS1
| 超分子 | 名称: Cytoplasmic dynein-A1/A2 motor domains bound to LIS1 タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#4 |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Cytoplasmic dynein 1 heavy chain 1
| 分子 | 名称: Cytoplasmic dynein 1 heavy chain 1 / タイプ: protein_or_peptide / ID: 1 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 533.055125 KDa |
| 組換発現 | 生物種:   Spodoptera frugiperda (ツマジロクサヨトウ) Spodoptera frugiperda (ツマジロクサヨトウ) |
| 配列 | 文字列: MSEPGGGGGE DGSAGLEVSA VQNVADVSVL QKHLRKLVPL LLEDGGEAPA ALEAALEEKS ALEQMRKFLS DPQVHTVLVE RSTLKEDVG DEGEEEKEFI SYNINIDIHY GVKSNSLAFI KRTPVIDADK PVSSQLRVLT LSEDSPYETL HSFISNAVAP F FKSYIRES ...文字列: MSEPGGGGGE DGSAGLEVSA VQNVADVSVL QKHLRKLVPL LLEDGGEAPA ALEAALEEKS ALEQMRKFLS DPQVHTVLVE RSTLKEDVG DEGEEEKEFI SYNINIDIHY GVKSNSLAFI KRTPVIDADK PVSSQLRVLT LSEDSPYETL HSFISNAVAP F FKSYIRES GKADRDGDKM APSVEKKIAE LEMGLLHLQQ NIEIPEISLP IHPMITNVAK QCYERGEKPK VTDFGDKVED PT FLNQLQS GVNRWIREIQ KVTKLDRDPA SGTALQEISF WLNLERALYR IQEKRESPEV LLTLDILKHG KRFHATVSFD TDT GLKQAL ETVNDYNPLM KDFPLNDLLS ATELDKIRQA LVAIFTHLRK IRNTKYPIQR ALRLVEAISR DLSSQLLKVL GTRK LMHVA YEEFEKVMVA CFEVFQTWDD EYEKLQVLLR DIVKRKREEN LKMVWRINPA HRKLQARLDQ MRKFRRQHEQ LRAVI VRVL RPQVTAVAQQ NQGEVPEPQD MKVAEVLFDA ADANAIEEVN LAYENVKEVD GLDVSKEGTE AWEAAMKRYD ERIDRV ETR ITARLRDQLG TAKNANEMFR IFSRFNALFV RPHIRGAIRE YQTQLIQRVK DDIESLHDKF KVQYPQSQAC KMSHVRD LP PVSGSIIWAK QIDRQLTAYM KRVEDVLGKG WENHVEGQKL KQDGDSFRMK LNTQEIFDDW ARKVQQRNLG VSGRIFTI E STRVRGRTGN VLKLKVNFLP EIITLSKEVR NLKWLGFRVP LAIVNKAHQA NQLYPFAISL IESVRTYERT CEKVEERNT ISLLVAGLKK EVQALIAEGI ALVWESYKLD PYVQRLAETV FNFQEKVDDL LIIEEKIDLE VRSLETCMYD HKTFSEILNR VQKAVDDLN LHSYSNLPIW VNKLDMEIER ILGVRLQAGL RAWTQVLLGQ AEDKAEVDMD TDAPQVSHKP GGEPKIKNVV H ELRITNQV IYLNPPIEEC RYKLYQEMFA WKMVVLSLPR IQSQRYQVGV HYELTEEEKF YRNALTRMPD GPVALEESYS AV MGIVSEV EQYVKVWLQY QCLWDMQAEN IYNRLGEDLN KWQALLVQIR KARGTFDNAE TKKEFGPVVI DYGKVQSKVN LKY DSWHKE VLSKFGQMLG SNMTEFHSQI SKSRQELEQH SVDTASTSDA VTFITYVQSL KRKIKQFEKQ VELYRNGQRL LEKQ RFQFP PSWLYIDNIE GEWGAFNDIM RRKDSAIQQQ VANLQMKIVQ EDRAVESRTT DLLTDWEKTK PVTGNLRPEE ALQAL TIYE GKFGRLKDDR EKCAKAKEAL ELTDTGLLSG SEERVQVALE ELQDLKGVWS ELSKVWEQID QMKEQPWVSV QPRKLR QNL DALLNQLKSF PARLRQYASY EFVQRLLKGY MKINMLVIEL KSEALKDRHW KQLMKRLHVN WVVSELTLGQ IWDVDLQ KN EAIVKDVLLV AQGEMALEEF LKQIREVWNT YELDLVNYQN KCRLIRGWDD LFNKVKEHIN SVSAMKLSPY YKVFEEDA L SWEDKLNRIM ALFDVWIDVQ RRWVYLEGIF TGSADIKHLL PVETQEFQSI STEFLALMKK VSKSPLVMDV LNIQGVQRS LERLADLLGE IQKALGEYLE RERSSFPRFY FVGDEDLLEI IGNSKNVAKL QKHFKKMFAG VSSIILNEDN SVVLGISSRE GEEVMFKTP VSITEHPKIN EWLTLVEKEM RVTLAKLLAE SVTEVEIFGK ATSIDPNTYI TWIDKYQAQL VVLSAQIAWS E NVETALSS MGGGGDAAPL HSVLSNVEVT LNVLADSVLM EQPPLRRRKL EHLITELVHQ RDVTRSLIKS KIDNAKSFEW LS QMRFYFD PKQTDVLQQL SIQMANAKFN YGFEYLGVQD KLVQTPLTDR CYLTMTQALE ARLGGSPFGP AGTGKTESVK ALG HQLGRF VLVFNCDETF DFQAMGRIFV GLCQVGAWGC FDEFNRLEER MLSAVSQQVQ CIQEALREHS NPNYDKTSAP ITCE LLNKQ VKVSPDMAIF ITMNPGYAGR SNLPDNLKKL FRSLAMTKPD RQLIAQVMLY SQGFRTAEVL ANKIVPFFKL CDEQL SSQS HYDFGLRALK SVLVSAGNVK RERIQKIKRE KEERGEAVDE GEIAENLPEQ EILIQSVCET MVPKLVAEDI PLLFSL LSD VFPGVQYHRG EMTALREELK KVCQEMYLTY GDGEEVGGMW VEKVLQLYQI TQINHGLMMV GPSGSGKSMA WRVLLKA LE RLEGVEGVAH IIDPKAISKD HLYGTLDPNT REWTDGLFTH VLRKIIDSVR GELQKRQWIV FDGDVDPEWV ENLNSVLD D NKLLTLPNGE RLSLPPNVRI MFEVQDLKYA TLATVSRCGM VWFSEDVLST DMIFNNFLAR LRSIPLDEGE DEAQRRRKG KEDEGEEAAS PMLQIQRDAA TIMQPYFTSN GLVTKALEHA FQLEHIMDLT RLRCLGSLFS MLHQACRNVA QYNANHPDFP MQIEQLERY IQRYLVYAIL WSLSGDSRLK MRAELGEYIR RITTVPLPTA PNIPIIDYEV SISGEWSPWQ AKVPQIEVET H KVAAPDVV VPTLDTVRHE ALLYTWLAEH KPLVLCGPPG SGKTMTLFSA LRALPDMEVV GLNFSSATTP ELLLKTFDHY CE YRRTPNG VVLAPVQLGK WLVLFCDEIN LPDMDKYGTQ RVISFIRQMV EHGGFYRTSD QTWVKLERIQ FVGACNPPTD PGR KPLSHR FLRHVPVVYV DYPGPASLTQ IYGTFNRAML RLIPSLRTYA EPLTAAMVEF YTMSQERFTQ DTQPHYIYSP REMT RWVRG IFEALRPLET LPVEGLIRIW AHEALRLFQD RLVEDEERRW TDENIDTVAL KHFPNIDREK AMSRPILYSN WLSKD YIPV DQEELRDYVK ARLKVFYEEE LDVPLVLFNE VLDHVLRIDR IFRQPQGHLL LIGVSGAGKT TLSRFVAWMN GLSVYQ IKV HRKYTGEDFD EDLRTVLRRS GCKNEKIAFI MDESNVLDSG FLERMNTLLA NGEVPGLFEG DEYATLMTQC KEGAQKE GL MLDSHEELYK WFTSQVIRNL HVVFTMNPSS EGLKDRAATS PALFNRCVLN WFGDWSTEAL YQVGKEFTSK MDLEKPNY I VPDYMPVVYD KLPQPPSHRE AIVNSCVFVH QTLHQANARL AKRGGRTMAI TPRHYLDFIN HYANLFHEKR SELEEQQMH LNVGLRKIKE TVDQVEELRR DLRIKSQELE VKNAAANDKL KKMVKDQQEA EKKKVMSQEI QEQLHKQQEV IADKQMSVKE DLDKVEPAV IEAQNAVKSI KKQHLVEVRS MANPPAAVKL ALESICLLLG ESTTDWKQIR SIIMRENFIP TIVNFSAEEI S DAIREKMK KNYMSNPSYN YEIVNRASLA CGPMVKWAIA QLNYADMLKR VEPLRNELQK LEDDAKDNQQ KANEVEQMIR DL EASIARY KEEYAVLISE AQAIKADLAA VEAKVNRSTA LLKSLSAERE RWEKTSETFK NQMSTIAGDC LLSAAFIAYA GYF DQQMRQ NLFTTWSHHL QQANIQFRTD IARTEYLSNA DERLRWQASS LPADDLCTEN AIMLKRFNRY PLIIDPSGQA TEFI MNEYK DRKITRTSFL DDAFRKNLES ALRFGNPLLV QDVESYDPVL NPVLNREVRR TGGRVLITLG DQDIDLSPSF VIFLS TRDP TVEFPPDLCS RVTFVNFTVT RSSLQSQCLN EVLKAERPDV DEKRSDLLKL QGEFQLRLRQ LEKSLLQALN EVKGRI LDD DTIITTLENL KREAAEVTRK VEETDIVMQE VETVSQQYLP LSTACSSIYF TMESLKQIHF LYQYSLQFFL DIYHNVL YE NPNLKGVTDH TQRLSIITKD LFQVAFNRVA RGMLHQDHIT FAMLLARIKL KGTVGEPTYD AEFQHFLRGN EIVLSAGS T PRIQGLTVEQ AEAVVRLSCL PAFKDLIAKV QADEQFGIWL DSSSPEQTVP YLWSEETPAT PIGQAIHRLL LIQAFRPDR LLAMAHMFVS TNLGESFMSI MEQPLDLTHI VGTEVKPNTP VLMCSVPGYD ASGHVEDLAA EQNTQITSIA IGSAEGFNQA DKAINTAVK SGRWVMLKNV HLAPGWLMQL EKKLHSLQPH ACFRLFLTME INPKVPVNLL RAGRIFVFEP PPGVKANMLR T FSSIPVSR ICKSPNERAR LYFLLAWFHA IIQERLRYAP LGWSKKYEFG ESDLRSACDT VDTWLDDTAK GRQNISPDKI PW SALKTLM AQSIYGGRVD NEFDQRLLNT FLERLFTTRS FDSEFKLACK VDGHKDIQMP DGIRREEFVQ WVELLPDTQT PSW LGLPNN AERVLLTTQG VDMISKMLKM QMLEDEDDLA YAETEKKTRT DSTSDGRPAW MRTLHTTASN WLHLIPQTLS HLKR TVENI KDPLFRFFER EVKMGAKLLQ DVRQDLADVV QVCEGKKKQT NYLRTLINEL VKGILPRSWS HYTVPAGMTV IQWVS DFSE RIKQLQNISL AAASGGAKEL KNIHVCLGGL FVPEAYITAT RQYVAQANSW SLEELCLEVN VTTSQGATLD ACSFGV TGL KLQGATCNNN KLSLSNAIST ALPLTQLRWV KQTNTEKKAS VVTLPVYLNF TRADLIFTVD FEIATKEDPR SFYERGV AV LCTE UniProtKB: Cytoplasmic dynein 1 heavy chain 1 |
-分子 #2: Platelet-activating factor acetylhydrolase IB subunit beta
| 分子 | 名称: Platelet-activating factor acetylhydrolase IB subunit beta タイプ: protein_or_peptide / ID: 2 / コピー数: 6 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 46.709984 KDa |
| 組換発現 | 生物種:   Spodoptera frugiperda (ツマジロクサヨトウ) Spodoptera frugiperda (ツマジロクサヨトウ) |
| 配列 | 文字列: MVLSQRQRDE LNRAIADYLR SNGYEEAYSV FKKEAELDVN EELDKKYAGL LEKKWTSVIR LQKKVMELES KLNEAKEEFT SGGPLGQKR DPKEWIPRPP EKYALSGHRS PVTRVIFHPV FSVMVSASED ATIKVWDYET GDFERTLKGH TDSVQDISFD H SGKLLASC ...文字列: MVLSQRQRDE LNRAIADYLR SNGYEEAYSV FKKEAELDVN EELDKKYAGL LEKKWTSVIR LQKKVMELES KLNEAKEEFT SGGPLGQKR DPKEWIPRPP EKYALSGHRS PVTRVIFHPV FSVMVSASED ATIKVWDYET GDFERTLKGH TDSVQDISFD H SGKLLASC SADMTIKLWD FQGFECIRTM HGHDHNVSSV AIMPNGDHIV SASRDKTIKM WEVQTGYCVK TFTGHREWVR MV RPNQDGT LIASCSNDQT VRVWVVATKE CKAELREHEH VVECISWAPE SSYSSISEAT GSETKKSGKP GPFLLSGSRD KTI KMWDVS TGMCLMTLVG HDNWVRGVLF HSGGKFILSC ADDKTLRVWD YKNKRCMKTL NAHEHFVTSL DFHKTAPYVV TGSV DQTVK VWECR UniProtKB: Platelet-activating factor acetylhydrolase IB subunit beta |
-分子 #3: Dynactin subunit 1
| 分子 | 名称: Dynactin subunit 1 / タイプ: protein_or_peptide / ID: 3 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Sus scrofa (ブタ) Sus scrofa (ブタ) |
| 分子量 | 理論値: 142.015484 KDa |
| 配列 | 文字列: MAQSKRHVYS RTPSGSRMSA EASARPLRVG SRVEVIGKGH RGTVAYVGAT LFATGKWVGV ILDEAKGKND GTVQGRKYFT CDEGHGIFV RQSQIQVFED GADTTSPETP DSSASKVLRR EGTDSNAKTS KLRGPKPKKA PTARKTTTRR PKPTRPASTG V AGASSSLG ...文字列: MAQSKRHVYS RTPSGSRMSA EASARPLRVG SRVEVIGKGH RGTVAYVGAT LFATGKWVGV ILDEAKGKND GTVQGRKYFT CDEGHGIFV RQSQIQVFED GADTTSPETP DSSASKVLRR EGTDSNAKTS KLRGPKPKKA PTARKTTTRR PKPTRPASTG V AGASSSLG PSGSASAGEL SSSEPSTPAQ TPLAAPIIPT PALTSPGAAP PLPSPSKEEE GLRAQVRDLE EKLETLRLKR AE DKAKLKE LEKHKIQLEQ VQEWKSKMQE QQADLQRRLK EARKEAKEAL EAKERYMEEM ADTADAIEMA TLDKEMAEER AES LQQEVE ALKERVDELT TDLEILKAEI EEKGSDGAAS SYQLKQLEEQ NARLKDALVR MRDLSSSEKQ EHVKLQKLME KKNQ ELEVV RQQRERLQEE LSQAESTIDE LKEQVDAALG AEEMVEMLTD RNLNLEEKVR ELRETVGDLE AMNEMNDELQ ENARE TELE LREQLDMAGA RVREAQKRVE AAQETVADYQ QTIKKYRQLT AHLQDVNREL TNQQEASVER QQQPPPETFD FKIKFA ETK AHAKAIEMEL RQMEVAQANR HMSLLTAFMP DSFLRPGGDH DCVLVLLLMP RLICKAELIR KQAQEKFDLS ENCSERP GL RGAAGEQLSF AAGLVYSLSL LQATLHRYEH ALSQCSVDVY KKVGSLYPEM SAHERSLDFL IELLHKDQLD ETVNVEPL T KAIKYYQHLY SIHLAEQPED STMQLADHIK FTQSALDCMS VEVGRLRAFL QGGQEASDIA LLLRDLETSC SDIRQFCKK IRRRMPGTDA PGIPAALAFG AQVSDTLLDC RKHLTWVVAV LQEVAAAAAQ LIAPLAENEG LPVAALEELA FKASEQIYGT PSSSPYECL RQSCNILIST MNKLATAMQE GEYDAERPPS KPPPVELRAA ALRAEITDAE GLGLKLEDRE TVIKELKKSL K IKGEELSE ANVRLSLLEK KLDSAAKDAD ERIEKVQTRL EETQALLRKK EKEFEETMDA LQADIDQLEA EKAELKQRLN SQ SKRTIEG IRGPPPSGIA TLVSGIAGEE QQRGGAPGQA PGIVPGPGLV KDSPLLLQQI SAMRLHISQL QHENSVLKGA QMK ASLAAL PPLHVAKLSL PPHEGPGSEL AAGALYRKTN QLLETLNQLS THTHVVDITR SSPAAKSPSA QLLEQVTQLK SLSD TIEKL KDEVLKETVS QRPGATVPTD FATFPSSAFL RAKEEQQDDT VYMGKVTFSC AAGLGQRHRL VLTQEQLHQL HDRLI S UniProtKB:  Dynactin subunit 1 Dynactin subunit 1 |
-分子 #4: Cytoplasmic dynein 1 intermediate chain 2
| 分子 | 名称: Cytoplasmic dynein 1 intermediate chain 2 / タイプ: protein_or_peptide / ID: 4 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 68.442141 KDa |
| 組換発現 | 生物種:   Spodoptera frugiperda (ツマジロクサヨトウ) Spodoptera frugiperda (ツマジロクサヨトウ) |
| 配列 | 文字列: MSDKSELKAE LERKKQRLAQ IREEKKRKEE ERKKKETDQK KEAVAPVQEE SDLEKKRREA EALLQSMGLT PESPIVPPPM SPSSKSVST PSEAGSQDSG DGAVGSRRGP IKLGMAKITQ VDFPPREIVT YTKETQTPVM AQPKEDEEED DDVVAPKPPI E PEEEKTLK ...文字列: MSDKSELKAE LERKKQRLAQ IREEKKRKEE ERKKKETDQK KEAVAPVQEE SDLEKKRREA EALLQSMGLT PESPIVPPPM SPSSKSVST PSEAGSQDSG DGAVGSRRGP IKLGMAKITQ VDFPPREIVT YTKETQTPVM AQPKEDEEED DDVVAPKPPI E PEEEKTLK KDEENDSKAP PHELTEEEKQ QILHSEEFLS FFDHSTRIVE RALSEQINIF FDYSGRDLED KEGEIQAGAK LS LNRQFFD ERWSKHRVVS CLDWSSQYPE LLVASYNNNE DAPHEPDGVA LVWNMKYKKT TPEYVFHCQS AVMSATFAKF HPN LVVGGT YSGQIVLWDN RSNKRTPVQR TPLSAAAHTH PVYCVNVVGT QNAHNLISIS TDGKICSWSL DMLSHPQDSM ELVH KQSKA VAVTSMSFPV GDVNNFVVGS EEGSVYTACR HGSKAGISEM FEGHQGPITG IHCHAAVGAV DFSHLFVTSS FDWTV KLWS TKNNKPLYSF EDNAGYVYDV MWSPTHPALF ACVDGMGRLD LWNLNNDTEV PTASISVEGN PALNRVRWTH SGREIA VGD SEGQIVIYDV GEQIAVPRND EWARFGRTLA EINANRADAE EEAATRIPA UniProtKB: Cytoplasmic dynein 1 intermediate chain 2 |
-分子 #5: ADENOSINE-5'-DIPHOSPHATE
| 分子 | 名称: ADENOSINE-5'-DIPHOSPHATE / タイプ: ligand / ID: 5 / コピー数: 6 / 式: ADP |
|---|---|
| 分子量 | 理論値: 427.201 Da |
| Chemical component information | 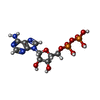 ChemComp-ADP: |
-分子 #6: MAGNESIUM ION
| 分子 | 名称: MAGNESIUM ION / タイプ: ligand / ID: 6 / コピー数: 4 / 式: MG |
|---|---|
| 分子量 | 理論値: 24.305 Da |
-分子 #7: ADENOSINE-5'-TRIPHOSPHATE
| 分子 | 名称: ADENOSINE-5'-TRIPHOSPHATE / タイプ: ligand / ID: 7 / コピー数: 2 / 式: ATP |
|---|---|
| 分子量 | 理論値: 507.181 Da |
| Chemical component information | 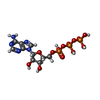 ChemComp-ATP: |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.2 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / 最大 デフォーカス(公称値): 4.0 µm / 最小 デフォーカス(公称値): 0.5 µm Bright-field microscopy / 最大 デフォーカス(公称値): 4.0 µm / 最小 デフォーカス(公称値): 0.5 µm |
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 平均電子線量: 53.0 e/Å2 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー


































 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)