+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of DSR2-DSAD1 (partial) complex | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Phage defense proteins /  ANTIVIRAL PROTEIN ANTIVIRAL PROTEIN | |||||||||
| 機能・相同性 | Uncharacterized protein 機能・相同性情報 機能・相同性情報 | |||||||||
| 生物種 |   Bacillus subtilis (枯草菌) / Bacillus subtilis (枯草菌) /   Bacillus phage SPBc2 (ファージ) Bacillus phage SPBc2 (ファージ) | |||||||||
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 2.49 Å クライオ電子顕微鏡法 / 解像度: 2.49 Å | |||||||||
 データ登録者 データ登録者 | Zhang JT / Jia N / Liu XY | |||||||||
| 資金援助 | 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2024 ジャーナル: Nat Commun / 年: 2024タイトル: Structural basis for phage-mediated activation and repression of bacterial DSR2 anti-phage defense system. 著者: Jun-Tao Zhang / Xiao-Yu Liu / Zhuolin Li / Xin-Yang Wei / Xin-Yi Song / Ning Cui / Jirui Zhong / Hongchun Li / Ning Jia /  要旨: Silent information regulator 2 (Sir2) proteins typically catalyze NAD-dependent protein deacetylation. The recently identified bacterial Sir2 domain-containing protein, defense-associated sirtuin 2 ...Silent information regulator 2 (Sir2) proteins typically catalyze NAD-dependent protein deacetylation. The recently identified bacterial Sir2 domain-containing protein, defense-associated sirtuin 2 (DSR2), recognizes the phage tail tube and depletes NAD to abort phage propagation, which is counteracted by the phage-encoded DSR anti-defense 1 (DSAD1), but their molecular mechanisms remain unclear. Here, we determine cryo-EM structures of inactive DSR2 in its apo form, DSR2-DSAD1 and DSR2-DSAD1-NAD, as well as active DSR2-tube and DSR2-tube-NAD complexes. DSR2 forms a tetramer with its C-terminal sensor domains (CTDs) in two distinct conformations: CTD or CTD. Monomeric, rather than oligomeric, tail tube proteins preferentially bind to CTD and activate Sir2 for NAD hydrolysis. DSAD1 binding to CTD allosterically inhibits tube binding and tube-mediated DSR2 activation. Our findings provide mechanistic insight into DSR2 assembly, tube-mediated DSR2 activation, and DSAD1-mediated inhibition and NAD substrate catalysis in bacterial DSR2 anti-phage defense systems. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_37925.map.gz emd_37925.map.gz | 229.6 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-37925-v30.xml emd-37925-v30.xml emd-37925.xml emd-37925.xml | 15.2 KB 15.2 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_37925.png emd_37925.png | 46.7 KB | ||
| マスクデータ |  emd_37925_msk_1.map emd_37925_msk_1.map | 244.1 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-37925.cif.gz emd-37925.cif.gz | 5.8 KB | ||
| その他 |  emd_37925_half_map_1.map.gz emd_37925_half_map_1.map.gz emd_37925_half_map_2.map.gz emd_37925_half_map_2.map.gz | 226.5 MB 226.5 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-37925 http://ftp.pdbj.org/pub/emdb/structures/EMD-37925 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-37925 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-37925 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8wyeMC  8wy8C  8wy9C  8wyaC  8wybC  8wycC  8wydC  8wyfC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_37925.map.gz / 形式: CCP4 / 大きさ: 244.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_37925.map.gz / 形式: CCP4 / 大きさ: 244.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ボクセルのサイズ | X=Y=Z: 0.827 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_37925_msk_1.map emd_37925_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
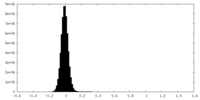
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_37925_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
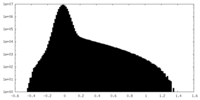
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_37925_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : CryoEM structure of DSR2-DSAD1 (half) complex
| 全体 | 名称: CryoEM structure of DSR2-DSAD1 (half) complex |
|---|---|
| 要素 |
|
-超分子 #1: CryoEM structure of DSR2-DSAD1 (half) complex
| 超分子 | 名称: CryoEM structure of DSR2-DSAD1 (half) complex / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:   Bacillus subtilis (枯草菌) Bacillus subtilis (枯草菌) |
-分子 #1: SIR2 family protein
| 分子 | 名称: SIR2 family protein / タイプ: protein_or_peptide / ID: 1 / 詳細: WP_029317421.1 / コピー数: 4 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Bacillus subtilis (枯草菌) Bacillus subtilis (枯草菌) |
| 分子量 | 理論値: 118.635789 KDa |
| 組換発現 | 生物種:   Escherichia coli (大腸菌) Escherichia coli (大腸菌) |
| 配列 | 文字列: MVKVDLESKR YGEKLKEVFL MLDNNVVECI KEITESSRNG KLVFFVGAGV STLSDYPQWW RLVDKYHEEL YGSPKKGNYS SDEYLRIPQ IFYNVKGEMA FDGILKDFFQ VDKPTNPIHD KILAMNPAHV ITTNYDNLID TACWKRGKYF SVISAEEDVA N ATSSRYLL ...文字列: MVKVDLESKR YGEKLKEVFL MLDNNVVECI KEITESSRNG KLVFFVGAGV STLSDYPQWW RLVDKYHEEL YGSPKKGNYS SDEYLRIPQ IFYNVKGEMA FDGILKDFFQ VDKPTNPIHD KILAMNPAHV ITTNYDNLID TACWKRGKYF SVISAEEDVA N ATSSRYLL KVHGDFRKGF KGENVVLKED DYLNYDQNYP LISNLMKTII ATHTIVFIGY GLGDYNINML LNWVRKLQKD SF HKPFFIR TDPSPIENET LIYYENKGLR IIDAASLIDS NEYDYLERYS AVMDLLIESQ ENKFITKDDE VIDYIYGKIS PLF ALQYIR KIDLKHVFEY DYHFEVNGTV VRHKNKGFGY MERFFELKES CDERSKLSKK QYERFNALFN FFEKNGVICM AKDA GTLNT SIEINSLAYH GKYDVMKKFI EEQSVSIEDD YKKAFFLACL GRWEESYDLY SNIILNSIDE SNGCVYYLSQ INRYR IYQS ITQAVTQFNG LGLLTFGRHY KPFTDEFLAR IEREMTNFNI DDLFNGMPFE FQKKYKILEF LSDNQFLYDD TVKLFE LTN KVRSEMSEGS YSFGMSSDIV VLLRLYDNLR FLYENCLWSV SFHEFHQYIR NSMSLLIEKA EYERTRDIDE LGFSFFG KK SGFFMEYYDF VNISRHFKID DIKNLERSCS IDKIRFGEQE KIEEYLVGIA EEITKQFSAN GMNVVFYTQF ISEAKAAL Y FAKYVKLSEE GLGKIVKALL FYFPERDLDI GKRYVWLERL TKCNELPKSI ISIIDDFLVL QAEKHIDQNY SEVSSNGLY SRDYGALIKH FEKNFISKRL SEITLCLTQD KQKQIDFLFK LLPLLSTNAK SHLLSFKSVE NINDLMNGIR IGLIDEFTPE HEELIIEYL ETRKVNYIVE KEKGIQTFSS NDYMSTFGIW YFLEEINNSK MEEFIGMDDQ YDFFVDPENF DYKKFIPSWL K NYNDKLLG KIAGNKHMKH HVIEVLKERV KNSNDKRYLE ILMNYFI |
-分子 #2: Bacillus phage SPbeta DSAD1 protein
| 分子 | 名称: Bacillus phage SPbeta DSAD1 protein / タイプ: protein_or_peptide / ID: 2 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Bacillus phage SPBc2 (ファージ) Bacillus phage SPBc2 (ファージ) |
| 分子量 | 理論値: 16.587791 KDa |
| 組換発現 | 生物種:   Escherichia coli (大腸菌) Escherichia coli (大腸菌) |
| 配列 | 文字列: MIEIFKDTGA THDLVYHSKI NTFVWDVEFD IVLSDSKELN KCYFVKCFNP YRINGKCDFA VSSIDIFSEG KRLLIENEFN FKITKAVHV ATSKDVTEIV LHLSERISSP FPIVKEVVYL DWSHPQFEKG GGSGGGSGGW SHPQFEK UniProtKB: Uncharacterized protein |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 50.0 µm / 照射モード: SPOT SCAN / 撮影モード: BRIGHT FIELD Bright-field microscopy / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 1.5 µm Bright-field microscopy / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 1.5 µm |
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 平均電子線量: 50.0 e/Å2 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 初期モデル | モデルのタイプ: INSILICO MODEL |
|---|---|
| 初期 角度割当 | タイプ: RANDOM ASSIGNMENT |
| 最終 角度割当 | タイプ: RANDOM ASSIGNMENT |
| 最終 再構成 | 解像度のタイプ: BY AUTHOR / 解像度: 2.49 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 使用した粒子像数: 946024 |
 ムービー
ムービー コントローラー
コントローラー











 Z
Z Y
Y X
X