+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 8k1s | ||||||
|---|---|---|---|---|---|---|---|
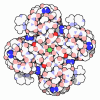
| タイトル | Potassium transporter KtrAB from Bacillus subtilis in ADP-bound state | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード |  TRANSPORT PROTEIN (運搬体タンパク質) / KtrAB / RCK / TRANSPORT PROTEIN (運搬体タンパク質) / KtrAB / RCK /  potassium (カリウム) / potassium (カリウム) /  transporter (運搬体タンパク質) transporter (運搬体タンパク質) | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報potassium:chloride symporter activity / monoatomic cation transmembrane transporter activity / potassium ion transport / identical protein binding /  細胞膜 細胞膜類似検索 - 分子機能 | ||||||
| 生物種 |   Bacillus subtilis (枯草菌) Bacillus subtilis (枯草菌) | ||||||
| 手法 |  電子顕微鏡法 / 電子顕微鏡法 /  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 2.83 Å クライオ電子顕微鏡法 / 解像度: 2.83 Å | ||||||
 データ登録者 データ登録者 | Chang, Y.K. / Chiang, W.T. / Hu, N.J. / Tsai, M.D. | ||||||
| 資金援助 |  台湾, 1件 台湾, 1件
| ||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2024 ジャーナル: Nat Commun / 年: 2024タイトル: Structural basis and synergism of ATP and Na activation in bacterial K uptake system KtrAB. 著者: Wesley Tien Chiang / Yao-Kai Chang / Wei-Han Hui / Shu-Wei Chang / Chen-Yi Liao / Yi-Chuan Chang / Chun-Jung Chen / Wei-Chen Wang / Chien-Chen Lai / Chun-Hsiung Wang / Siou-Ying Luo / Ya-Ping ...著者: Wesley Tien Chiang / Yao-Kai Chang / Wei-Han Hui / Shu-Wei Chang / Chen-Yi Liao / Yi-Chuan Chang / Chun-Jung Chen / Wei-Chen Wang / Chien-Chen Lai / Chun-Hsiung Wang / Siou-Ying Luo / Ya-Ping Huang / Shan-Ho Chou / Tzyy-Leng Horng / Ming-Hon Hou / Stephen P Muench / Ren-Shiang Chen / Ming-Daw Tsai / Nien-Jen Hu /   要旨: The K uptake system KtrAB is essential for bacterial survival in low K environments. The activity of KtrAB is regulated by nucleotides and Na. Previous studies proposed a putative gating mechanism of ...The K uptake system KtrAB is essential for bacterial survival in low K environments. The activity of KtrAB is regulated by nucleotides and Na. Previous studies proposed a putative gating mechanism of KtrB regulated by KtrA upon binding to ATP or ADP. However, how Na activates KtrAB and the Na binding site remain unknown. Here we present the cryo-EM structures of ATP- and ADP-bound KtrAB from Bacillus subtilis (BsKtrAB) both solved at 2.8 Å. A cryo-EM density at the intra-dimer interface of ATP-KtrA was identified as Na, as supported by X-ray crystallography and ICP-MS. Thermostability assays and functional studies demonstrated that Na binding stabilizes the ATP-bound BsKtrAB complex and enhances its K flux activity. Comparing ATP- and ADP-BsKtrAB structures suggests that BsKtrB Arg417 and Phe91 serve as a channel gate. The synergism of ATP and Na in activating BsKtrAB is likely applicable to Na-activated K channels in central nervous system. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  8k1s.cif.gz 8k1s.cif.gz | 458.6 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb8k1s.ent.gz pdb8k1s.ent.gz | 378 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  8k1s.json.gz 8k1s.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/k1/8k1s https://data.pdbj.org/pub/pdb/validation_reports/k1/8k1s ftp://data.pdbj.org/pub/pdb/validation_reports/k1/8k1s ftp://data.pdbj.org/pub/pdb/validation_reports/k1/8k1s | HTTPS FTP |
|---|
-関連構造データ
| 関連構造データ |  36800MC  8k16C  8k1kC  8k1tC  8k1uC  8xmhC  8xmiC M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
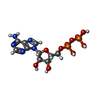
| #1: タンパク質 | 分子量: 24916.760 Da / 分子数: 8 / 由来タイプ: 組換発現 / 由来: (組換発現)   Bacillus subtilis (枯草菌) / 遺伝子: ktrA, yuaA, BSU31090 / 発現宿主: Bacillus subtilis (枯草菌) / 遺伝子: ktrA, yuaA, BSU31090 / 発現宿主:   Escherichia coli (大腸菌) / 参照: UniProt: O32080 Escherichia coli (大腸菌) / 参照: UniProt: O32080#2: タンパク質 | 分子量: 48471.539 Da / 分子数: 4 / 由来タイプ: 組換発現 / 由来: (組換発現)   Bacillus subtilis (枯草菌) / 遺伝子: ktrB, yubG, BSU31100 / 発現宿主: Bacillus subtilis (枯草菌) / 遺伝子: ktrB, yubG, BSU31100 / 発現宿主:   Escherichia coli (大腸菌) / 参照: UniProt: O32081 Escherichia coli (大腸菌) / 参照: UniProt: O32081#3: 化合物 | ChemComp-ADP /  アデノシン二リン酸 アデノシン二リン酸#4: 化合物 | ChemComp-K / 研究の焦点であるリガンドがあるか | Y | |
|---|
-実験情報
-実験
| 実験 | 手法:  電子顕微鏡法 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法:  単粒子再構成法 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 |
| ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 分子量 |
| ||||||||||||||||||||||||||||
| 由来(天然) |
| ||||||||||||||||||||||||||||
| 由来(組換発現) |
| ||||||||||||||||||||||||||||
| 緩衝液 | pH: 8 詳細: 20 mM Tris-HCl pH 8.0, 70 mM NaCl, 30 mM KCl, 0.75 mM 6-cyclohexyl-1-hexyl-beta-D-maltoside, 0.1 mM ADP | ||||||||||||||||||||||||||||
| 試料 | 濃度: 0.24 mg/ml / 包埋: NO / シャドウイング: NO / 染色 : NO / 凍結 : NO / 凍結 : YES : YES | ||||||||||||||||||||||||||||
| 試料支持 | グリッドの材料: COPPER / グリッドのサイズ: 200 divisions/in. / グリッドのタイプ: Quantifoil R2/1 | ||||||||||||||||||||||||||||
急速凍結 | 装置: FEI VITROBOT MARK IV / 凍結剤: ETHANE / 湿度: 100 % / 凍結前の試料温度: 277 K |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源 : :  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD Bright-field microscopy / 倍率(公称値): 105000 X / 最大 デフォーカス(公称値): 2200 nm / 最小 デフォーカス(公称値): 1500 nm Bright-field microscopy / 倍率(公称値): 105000 X / 最大 デフォーカス(公称値): 2200 nm / 最小 デフォーカス(公称値): 1500 nm |
| 撮影 | 平均露光時間: 2.5 sec. / 電子線照射量: 36 e/Å2 フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 撮影したグリッド数: 1 / 実像数: 6919 |
- 解析
解析
| EMソフトウェア |
| ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||
| 対称性 | 点対称性 : C2 (2回回転対称 : C2 (2回回転対称 ) ) | ||||||||||||||||||||||||
3次元再構成 | 解像度: 2.83 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 294844 / 対称性のタイプ: POINT | ||||||||||||||||||||||||
| 原子モデル構築 | 3D fitting-ID: 1 / Source name: PDB / タイプ: experimental model
| ||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー








 PDBj
PDBj