+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 8eax | ||||||
|---|---|---|---|---|---|---|---|
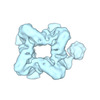
| タイトル | Octameric prenyltransferase domain of fusicoccadiene Synthase with C2 symmetry sans transiently associating cyclase domains | ||||||
 要素 要素 | Fusicoccadiene synthase Fusicocca-2,10(14)-diene synthase Fusicocca-2,10(14)-diene synthase | ||||||
 キーワード キーワード |  TRANSFERASE (転移酵素) / TRANSFERASE (転移酵素) /  Terpene synthase / Terpene synthase /  Prenyltransferase (プレニル基転移酵素) Prenyltransferase (プレニル基転移酵素) | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報 fusicocca-2,10(14)-diene synthase / alcohol biosynthetic process / mycotoxin biosynthetic process / geranylgeranyl diphosphate synthase / fusicocca-2,10(14)-diene synthase / alcohol biosynthetic process / mycotoxin biosynthetic process / geranylgeranyl diphosphate synthase /  farnesyltranstransferase activity / isoprenoid biosynthetic process / farnesyltranstransferase activity / isoprenoid biosynthetic process /  lyase activity / lyase activity /  metal ion binding metal ion binding類似検索 - 分子機能 | ||||||
| 生物種 |   Diaporthe amygdali (菌類) Diaporthe amygdali (菌類) | ||||||
| 手法 |  電子顕微鏡法 / 電子顕微鏡法 /  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.73 Å クライオ電子顕微鏡法 / 解像度: 3.73 Å | ||||||
 データ登録者 データ登録者 | Faylo, J.L. / van Eeuwen, T. / Christianson, D.W. | ||||||
| 資金援助 |  米国, 1件 米国, 1件
| ||||||
 引用 引用 |  ジャーナル: Biochemistry / 年: 2022 ジャーナル: Biochemistry / 年: 2022タイトル: Transient Prenyltransferase-Cyclase Association in Fusicoccadiene Synthase, an Assembly-Line Terpene Synthase. 著者: Jacque L Faylo / Trevor van Eeuwen / Kushol Gupta / Kenji Murakami / David W Christianson /  要旨: Fusicoccadiene synthase from the fungus (PaFS) is an assembly-line terpene synthase that catalyzes the first two steps in the biosynthesis of Fusiccocin A, a diterpene glycoside. The C-terminal ...Fusicoccadiene synthase from the fungus (PaFS) is an assembly-line terpene synthase that catalyzes the first two steps in the biosynthesis of Fusiccocin A, a diterpene glycoside. The C-terminal prenyltransferase domain of PaFS catalyzes the condensation of one molecule of C dimethylallyl diphosphate and three molecules of C isopentenyl diphosphate to form C geranylgeranyl diphosphate, which then transits to the cyclase domain for cyclization to form fusicoccadiene. Previous structural studies of PaFS using electron microscopy (EM) revealed a central octameric prenyltransferase core with eight cyclase domains tethered in random distal positions through flexible 70-residue linkers. However, proximal prenyltransferase-cyclase configurations could be captured by covalent cross-linking and observed by cryo-EM and mass spectrometry. Here, we use cryo-EM to show that proximally configured prenyltransferase-cyclase complexes are observable even in the absence of covalent cross-linking; moreover, such complexes can involve multiple cyclase domains. A conserved basic patch on the prenyltransferase domain comprises the primary touchpoint with the cyclase domain. These results support a model for transient prenyltransferase-cyclase association in which the cyclase domains of PaFS are in facile equilibrium between proximal associated and random distal positions relative to the central prenyltransferase octamer. The results of biophysical measurements using small-angle X-ray scattering, analytical ultracentrifugation, dynamic light scattering, and size-exclusion chromatography in-line with multi-angle light scattering are consistent with this model. This model accordingly provides a framework for understanding substrate transit between the prenyltransferase and cyclase domains as well as the cooperativity observed for geranylgeranyl diphosphate cyclization. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  8eax.cif.gz 8eax.cif.gz | 439.5 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb8eax.ent.gz pdb8eax.ent.gz | 345.7 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  8eax.json.gz 8eax.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/ea/8eax https://data.pdbj.org/pub/pdb/validation_reports/ea/8eax ftp://data.pdbj.org/pub/pdb/validation_reports/ea/8eax ftp://data.pdbj.org/pub/pdb/validation_reports/ea/8eax | HTTPS FTP |
|---|
-関連構造データ
| 関連構造データ |  27989MC M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
| #1: タンパク質 |  Fusicocca-2,10(14)-diene synthase / FS / Fusicoccin A biosynthetic gene clusters protein 1 / PaDC4:GGS Fusicocca-2,10(14)-diene synthase / FS / Fusicoccin A biosynthetic gene clusters protein 1 / PaDC4:GGS分子量: 83927.977 Da / 分子数: 8 / 由来タイプ: 組換発現 / 由来: (組換発現)   Diaporthe amygdali (菌類) / 遺伝子: PaFS, orf1 / 発現宿主: Diaporthe amygdali (菌類) / 遺伝子: PaFS, orf1 / 発現宿主:   Escherichia coli BL21(DE3) (大腸菌) Escherichia coli BL21(DE3) (大腸菌)参照: UniProt: A2PZA5,  fusicocca-2,10(14)-diene synthase, geranylgeranyl diphosphate synthase fusicocca-2,10(14)-diene synthase, geranylgeranyl diphosphate synthase |
|---|
-実験情報
-実験
| 実験 | 手法:  電子顕微鏡法 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法:  単粒子再構成法 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: Octamer of the prenylstransferase domain of fusicoccadiene synthase from Phomopsis amygdali (PaFS) タイプ: COMPLEX / Entity ID: all / 由来: RECOMBINANT |
|---|---|
| 分子量 | 値: 0.392 MDa / 実験値: YES |
| 由来(天然) | 生物種:   Diaporthe amygdali (菌類) Diaporthe amygdali (菌類) |
| 由来(組換発現) | 生物種:   Escherichia coli BL21(DE3) (大腸菌) Escherichia coli BL21(DE3) (大腸菌) |
| 緩衝液 | pH: 7.5 |
| 試料 | 包埋: NO / シャドウイング: NO / 染色 : NO / 凍結 : NO / 凍結 : YES : YES |
急速凍結 | 凍結剤: ETHANE |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源 : :  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: SPOT SCAN FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: SPOT SCAN |
| 電子レンズ | モード: BRIGHT FIELD Bright-field microscopy / 最大 デフォーカス(公称値): 2500 nm / 最小 デフォーカス(公称値): 1000 nm Bright-field microscopy / 最大 デフォーカス(公称値): 2500 nm / 最小 デフォーカス(公称値): 1000 nm |
| 撮影 | 電子線照射量: 52 e/Å2 / 検出モード: SUPER-RESOLUTION フィルム・検出器のモデル: FEI FALCON III (4k x 4k) |
- 解析
解析
| ソフトウェア | 名称: PHENIX / バージョン: dev_3736: / 分類: 精密化 | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||
3次元再構成 | 解像度: 3.73 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 151710 / 対称性のタイプ: POINT | ||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー

























 PDBj
PDBj