+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 8 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Symmetry expansion of yeast cytoplasmic dynein-1 bound to Lis1 in the chi conformation. | |||||||||
 要素 要素 |
| |||||||||
 キーワード キーワード |  MOTOR PROTEIN (モータータンパク質) / MOTOR PROTEIN (モータータンパク質) /  dynein (ダイニン) / transport dynein (ダイニン) / transport | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報positive regulation of microtubule plus-end binding / microtubule sliding / microtubule organizing center organization / nuclear migration along microtubule / vesicle transport along microtubule / Antigen processing: Ubiquitination & Proteasome degradation /  dynein complex / microtubule plus-end binding / minus-end-directed microtubule motor activity / dynein light intermediate chain binding ...positive regulation of microtubule plus-end binding / microtubule sliding / microtubule organizing center organization / nuclear migration along microtubule / vesicle transport along microtubule / Antigen processing: Ubiquitination & Proteasome degradation / dynein complex / microtubule plus-end binding / minus-end-directed microtubule motor activity / dynein light intermediate chain binding ...positive regulation of microtubule plus-end binding / microtubule sliding / microtubule organizing center organization / nuclear migration along microtubule / vesicle transport along microtubule / Antigen processing: Ubiquitination & Proteasome degradation /  dynein complex / microtubule plus-end binding / minus-end-directed microtubule motor activity / dynein light intermediate chain binding / nuclear migration / microtubule associated complex / dynein intermediate chain binding / dynein complex binding / microtubule-based movement / establishment of mitotic spindle orientation / cytoplasmic microtubule / dynein complex / microtubule plus-end binding / minus-end-directed microtubule motor activity / dynein light intermediate chain binding / nuclear migration / microtubule associated complex / dynein intermediate chain binding / dynein complex binding / microtubule-based movement / establishment of mitotic spindle orientation / cytoplasmic microtubule /  動原体 / 動原体 /  紡錘体 / 紡錘体 /  核膜 / 核膜 /  微小管 / 微小管 /  細胞分裂 / 細胞分裂 /  ATP hydrolysis activity / ATP hydrolysis activity /  ATP binding / identical protein binding / ATP binding / identical protein binding /  細胞核 / 細胞核 /  細胞質 細胞質類似検索 - 分子機能 | |||||||||
| 生物種 |   Saccharomyces cerevisiae (パン酵母) Saccharomyces cerevisiae (パン酵母) | |||||||||
| 手法 |  電子顕微鏡法 / 電子顕微鏡法 /  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.6 Å クライオ電子顕微鏡法 / 解像度: 3.6 Å | |||||||||
 データ登録者 データ登録者 | Reimer, J.M. / Lahiri, I. / Leschziner, A.E. | |||||||||
| 資金援助 |  米国, 2件 米国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Nat Struct Mol Biol / 年: 2023 ジャーナル: Nat Struct Mol Biol / 年: 2023タイトル: Lis1 relieves cytoplasmic dynein-1 autoinhibition by acting as a molecular wedge. 著者: Eva P Karasmanis / Janice M Reimer / Agnieszka A Kendrick / Kendrick H V Nguyen / Jennifer A Rodriguez / Joey B Truong / Indrajit Lahiri / Samara L Reck-Peterson / Andres E Leschziner /   要旨: Cytoplasmic dynein-1 transports intracellular cargo towards microtubule minus ends. Dynein is autoinhibited and undergoes conformational changes to form an active complex that consists of one or two ...Cytoplasmic dynein-1 transports intracellular cargo towards microtubule minus ends. Dynein is autoinhibited and undergoes conformational changes to form an active complex that consists of one or two dynein dimers, the dynactin complex, and activating adapter(s). The Lissencephaly 1 gene, LIS1, is genetically linked to the dynein pathway from fungi to mammals and is mutated in people with the neurodevelopmental disease lissencephaly. Lis1 is required for active dynein complexes to form, but how it enables this is unclear. Here, we present a structure of two yeast dynein motor domains with two Lis1 dimers wedged in-between. The contact sites between dynein and Lis1 in this structure, termed 'Chi,' are required for Lis1's regulation of dynein in Saccharomyces cerevisiae in vivo and the formation of active human dynein-dynactin-activating adapter complexes in vitro. We propose that this structure represents an intermediate in dynein's activation pathway, revealing how Lis1 relieves dynein's autoinhibited state. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  8e00.cif.gz 8e00.cif.gz | 573.2 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb8e00.ent.gz pdb8e00.ent.gz | 449.9 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  8e00.json.gz 8e00.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/e0/8e00 https://data.pdbj.org/pub/pdb/validation_reports/e0/8e00 ftp://data.pdbj.org/pub/pdb/validation_reports/e0/8e00 ftp://data.pdbj.org/pub/pdb/validation_reports/e0/8e00 | HTTPS FTP |
|---|
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 331524.000 Da / 分子数: 1 / 由来タイプ: 組換発現 / 詳細: 100% identical to UniParc UPI0005D9E17C 由来: (組換発現)   Saccharomyces cerevisiae (パン酵母) Saccharomyces cerevisiae (パン酵母)遺伝子: DYN1, GI527_G0003698 / 発現宿主:   Saccharomyces cerevisiae (パン酵母) / 参照: UniProt: A0A8H4FAJ6 Saccharomyces cerevisiae (パン酵母) / 参照: UniProt: A0A8H4FAJ6 | ||||||||
|---|---|---|---|---|---|---|---|---|---|
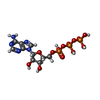
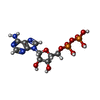
| #2: タンパク質 | 分子量: 57030.617 Da / 分子数: 2 / 由来タイプ: 組換発現 由来: (組換発現)   Saccharomyces cerevisiae (パン酵母) Saccharomyces cerevisiae (パン酵母)遺伝子: PAC1, LIS1, YOR269W / 発現宿主:   Saccharomyces cerevisiae (パン酵母) / 参照: UniProt: P39946 Saccharomyces cerevisiae (パン酵母) / 参照: UniProt: P39946#3: 化合物 |  アデノシン三リン酸 アデノシン三リン酸#4: 化合物 | ChemComp-ADP / |  アデノシン二リン酸 アデノシン二リン酸研究の焦点であるリガンドがあるか | Y | 配列の詳細 | Dynein heavy chain, cytoplasmic sequence is 100% identical to UniParc UPI0005D9E17C | |
-実験情報
-実験
| 実験 | 手法:  電子顕微鏡法 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法:  単粒子再構成法 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: cytoplasmic dynein(E2448Q) bound to Lis1 in chi conformation タイプ: COMPLEX / Entity ID: #1-#2 / 由来: RECOMBINANT |
|---|---|
| 由来(天然) | 生物種:   Saccharomyces cerevisiae (パン酵母) Saccharomyces cerevisiae (パン酵母) |
| 由来(組換発現) | 生物種:   Saccharomyces cerevisiae (パン酵母) Saccharomyces cerevisiae (パン酵母) |
| 緩衝液 | pH: 7.4 |
| 試料 | 包埋: NO / シャドウイング: NO / 染色 : NO / 凍結 : NO / 凍結 : YES / 詳細: streptavidin affinity grids were used : YES / 詳細: streptavidin affinity grids were used |
急速凍結 | 凍結剤: ETHANE |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源 : :  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD Bright-field microscopy / 最大 デフォーカス(公称値): 2700 nm / 最小 デフォーカス(公称値): 2000 nm Bright-field microscopy / 最大 デフォーカス(公称値): 2700 nm / 最小 デフォーカス(公称値): 2000 nm |
| 撮影 | 電子線照射量: 58.3 e/Å2 フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) |
- 解析
解析
CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
3次元再構成 | 解像度: 3.6 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 46770 / 対称性のタイプ: POINT | ||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー






 PDBj
PDBj