+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure if bacterioferritin holoform | |||||||||
 マップデータ マップデータ | Final Map | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード |  Bacterioferritin / METAL BINDING PROTEIN Bacterioferritin / METAL BINDING PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報 ferroxidase / intracellular sequestering of iron ion / ferroxidase / intracellular sequestering of iron ion /  ferroxidase activity / ferroxidase activity /  ferric iron binding / iron ion transport / iron ion binding / ferric iron binding / iron ion transport / iron ion binding /  heme binding / heme binding /  細胞質基質 細胞質基質類似検索 - 分子機能 | |||||||||
| 生物種 |   Streptomyces coelicolor (バクテリア) Streptomyces coelicolor (バクテリア) | |||||||||
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.3 Å クライオ電子顕微鏡法 / 解像度: 3.3 Å | |||||||||
 データ登録者 データ登録者 | Jobichen C / Sivaraman J | |||||||||
| 資金援助 | 1件
| |||||||||
 引用 引用 |  ジャーナル: PNAS Nexus / 年: 2023 ジャーナル: PNAS Nexus / 年: 2023タイトル: Bacterioferritin nanocage structures uncover the biomineralization process in ferritins. 著者: Chacko Jobichen / Tan Ying Chong / Rajesh Rattinam / Sandip Basak / Mahalashmi Srinivasan / Yeu Khai Choong / Kannu Priya Pandey / Tran Bich Ngoc / Jian Shi / Jayaraman Angayarkanni / J Sivaraman /    要旨: Iron is an essential element involved in various metabolic processes. The ferritin family of proteins forms nanocage assembly and is involved in iron oxidation, storage, and mineralization. Although ...Iron is an essential element involved in various metabolic processes. The ferritin family of proteins forms nanocage assembly and is involved in iron oxidation, storage, and mineralization. Although several structures of human ferritins and bacterioferritins have been solved, there is still no complete structure that shows both the trapped Fe-biomineral cluster and the nanocage. Furthermore, whereas the mechanism of iron trafficking has been explained using various approaches, structural details on the biomineralization process (i.e. the formation of the mineral itself) are generally lacking. Here, we report the cryo-electron microscopy (cryo-EM) structures of apoform and biomineral bound form (holoforms) of the bacterioferritin (ScBfr) nanocage and the subunit crystal structure. The holoforms show different stages of Fe-biomineral accumulation inside the nanocage, in which the connections exist in two of the fourfold channels of the nanocage between the C-terminal of the ScBfr monomers and the Fe-biomineral cluster. The mutation and truncation of the bacterioferritin residues involved in these connections significantly reduced the iron and phosphate binding in comparison with those of the wild type and together explain the underlying mechanism. Collectively, our results represent a prototype for the bacterioferritin nanocage, which reveals insight into its biomineralization and the potential channel for bacterioferritin-associated iron trafficking. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_33645.map.gz emd_33645.map.gz | 59.7 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-33645-v30.xml emd-33645-v30.xml emd-33645.xml emd-33645.xml | 14.8 KB 14.8 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_33645.png emd_33645.png | 88.7 KB | ||
| その他 |  emd_33645_half_map_1.map.gz emd_33645_half_map_1.map.gz emd_33645_half_map_2.map.gz emd_33645_half_map_2.map.gz | 45.9 MB 45.9 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-33645 http://ftp.pdbj.org/pub/emdb/structures/EMD-33645 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-33645 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-33645 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_33645.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_33645.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Final Map | ||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.858 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: Half Map 2
| ファイル | emd_33645_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half Map 2 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Half Map 1
| ファイル | emd_33645_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half Map 1 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Bacterioferritin
| 全体 | 名称: Bacterioferritin |
|---|---|
| 要素 |
|
-超分子 #1: Bacterioferritin
| 超分子 | 名称: Bacterioferritin / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:   Streptomyces coelicolor (バクテリア) Streptomyces coelicolor (バクテリア) |
| 分子量 | 理論値: 480 KDa |
-分子 #1: Bacterioferritin
| 分子 | 名称: Bacterioferritin / タイプ: protein_or_peptide / ID: 1 / コピー数: 24 / 光学異性体: LEVO / EC番号:  ferroxidase ferroxidase |
|---|---|
| 由来(天然) | 生物種:   Streptomyces coelicolor (バクテリア) / 株: ATCC BAA-471 / A3(2) / M145 Streptomyces coelicolor (バクテリア) / 株: ATCC BAA-471 / A3(2) / M145 |
| 分子量 | 理論値: 18.434775 KDa |
| 組換発現 | 生物種:   Escherichia coli 'BL21-Gold(DE3)pLysS AG' (大腸菌) Escherichia coli 'BL21-Gold(DE3)pLysS AG' (大腸菌) |
| 配列 | 文字列: MQGDPEVIEF LNEQLTAELT AINQYFLHAK LQDHKGWTKL AKYTRAESFD EMRHAEVLTD RILLLDGLPN YQRLFHVRVG QSVTEMFQA DREVELEAID RLRRGIEVMR AKHDITSANV FEAILADEEH HIDYLETQLD LIEKLGESLY LSTVIEQTQ UniProtKB:  Bacterioferritin Bacterioferritin |
-分子 #2: FE (II) ION
| 分子 | 名称: FE (II) ION / タイプ: ligand / ID: 2 / コピー数: 24 / 式: FE2 |
|---|---|
| 分子量 | 理論値: 55.845 Da |
-分子 #3: FE (III) ION
| 分子 | 名称: FE (III) ION / タイプ: ligand / ID: 3 / コピー数: 24 / 式: FE |
|---|---|
| 分子量 | 理論値: 55.845 Da |
-分子 #4: PROTOPORPHYRIN IX CONTAINING FE
| 分子 | 名称: PROTOPORPHYRIN IX CONTAINING FE / タイプ: ligand / ID: 4 / コピー数: 12 / 式: HEM |
|---|---|
| 分子量 | 理論値: 616.487 Da |
| Chemical component information | 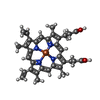 ChemComp-HEM: |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 1.8 mg/mL |
|---|---|
| 緩衝液 | pH: 7.4 |
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / 最大 デフォーカス(公称値): 2.5 µm Bright-field microscopy / 最大 デフォーカス(公称値): 2.5 µm最小 デフォーカス(公称値): 0.7000000000000001 µm |
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 平均電子線量: 1.8 e/Å2 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 初期モデル | モデルのタイプ: PDB ENTRY PDBモデル - PDB ID: |
|---|---|
| 初期 角度割当 | タイプ: PROJECTION MATCHING |
| 最終 角度割当 | タイプ: ANGULAR RECONSTITUTION |
| 最終 再構成 | 解像度のタイプ: BY AUTHOR / 解像度: 3.3 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 使用した粒子像数: 8174 |
 ムービー
ムービー コントローラー
コントローラー

















 Z
Z Y
Y X
X


















