+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Structure of the formin INF2 bound to the barbed end of F-actin. | ||||||||||||
 マップデータ マップデータ | Sharpened, local-resolution filtered cryo-EM density map of the formin INF2 bound to the barbed end of actin filaments. | ||||||||||||
 試料 試料 |
| ||||||||||||
 キーワード キーワード |  actin (アクチン) / actin (アクチン) /  formin / INF2 / actin end / barbed end / formin / INF2 / actin end / barbed end /  STRUCTURAL PROTEIN (タンパク質) STRUCTURAL PROTEIN (タンパク質) | ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報cytoskeletal motor activator activity /  regulation of mitochondrial fission / regulation of mitochondrial fission /  tropomyosin binding / tropomyosin binding /  myosin heavy chain binding / mesenchyme migration / myosin heavy chain binding / mesenchyme migration /  troponin I binding / actin filament bundle / filamentous actin / skeletal muscle thin filament assembly / actin filament bundle assembly ...cytoskeletal motor activator activity / troponin I binding / actin filament bundle / filamentous actin / skeletal muscle thin filament assembly / actin filament bundle assembly ...cytoskeletal motor activator activity /  regulation of mitochondrial fission / regulation of mitochondrial fission /  tropomyosin binding / tropomyosin binding /  myosin heavy chain binding / mesenchyme migration / myosin heavy chain binding / mesenchyme migration /  troponin I binding / actin filament bundle / filamentous actin / skeletal muscle thin filament assembly / actin filament bundle assembly / striated muscle thin filament / skeletal muscle myofibril / actin monomer binding / skeletal muscle fiber development / troponin I binding / actin filament bundle / filamentous actin / skeletal muscle thin filament assembly / actin filament bundle assembly / striated muscle thin filament / skeletal muscle myofibril / actin monomer binding / skeletal muscle fiber development /  stress fiber / stress fiber /  titin binding / actin filament polymerization / titin binding / actin filament polymerization /  filopodium / filopodium /  マイクロフィラメント / マイクロフィラメント /  加水分解酵素; 酸無水物に作用; 酸無水物に作用・細胞または細胞小器官の運動に関与 / 加水分解酵素; 酸無水物に作用; 酸無水物に作用・細胞または細胞小器官の運動に関与 /  small GTPase binding / calcium-dependent protein binding / small GTPase binding / calcium-dependent protein binding /  lamellipodium / lamellipodium /  cell body / cell body /  actin binding / actin binding /  hydrolase activity / protein domain specific binding / hydrolase activity / protein domain specific binding /  calcium ion binding / positive regulation of gene expression / perinuclear region of cytoplasm / magnesium ion binding / calcium ion binding / positive regulation of gene expression / perinuclear region of cytoplasm / magnesium ion binding /  ATP binding / identical protein binding / ATP binding / identical protein binding /  細胞質 細胞質類似検索 - 分子機能 | ||||||||||||
| 生物種 |   Oryctolagus cuniculus (ウサギ) / Oryctolagus cuniculus (ウサギ) /   Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||||||||
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.41 Å クライオ電子顕微鏡法 / 解像度: 3.41 Å | ||||||||||||
 データ登録者 データ登録者 | Oosterheert W / Boiero Sanders M / Funk J / Prumbaum D / Raunser S / Bieling P | ||||||||||||
| 資金援助 |  ドイツ, European Union, 3件 ドイツ, European Union, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: Science / 年: 2024 ジャーナル: Science / 年: 2024タイトル: Molecular mechanism of actin filament elongation by formins. 著者: Wout Oosterheert / Micaela Boiero Sanders / Johanna Funk / Daniel Prumbaum / Stefan Raunser / Peter Bieling /  要旨: Formins control the assembly of actin filaments (F-actin) that drive cell morphogenesis and motility in eukaryotes. However, their molecular interaction with F-actin and their mechanism of action ...Formins control the assembly of actin filaments (F-actin) that drive cell morphogenesis and motility in eukaryotes. However, their molecular interaction with F-actin and their mechanism of action remain unclear. In this work, we present high-resolution cryo-electron microscopy structures of F-actin barbed ends bound by three distinct formins, revealing a common asymmetric formin conformation imposed by the filament. Formation of new intersubunit contacts during actin polymerization sterically displaces formin and triggers its translocation. This "undock-and-lock" mechanism explains how actin-filament growth is coordinated with formin movement. Filament elongation speeds are controlled by the positioning and stability of actin-formin interfaces, which distinguish fast and slow formins. Furthermore, we provide a structure of the actin-formin-profilin ring complex, which resolves how profilin is rapidly released from the barbed end during filament elongation. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_19522.map.gz emd_19522.map.gz | 106.3 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-19522-v30.xml emd-19522-v30.xml emd-19522.xml emd-19522.xml | 40.2 KB 40.2 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_19522_fsc.xml emd_19522_fsc.xml | 12.8 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_19522.png emd_19522.png | 94.8 KB | ||
| マスクデータ |  emd_19522_msk_1.map emd_19522_msk_1.map emd_19522_msk_2.map emd_19522_msk_2.map | 178 MB 178 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-19522.cif.gz emd-19522.cif.gz | 8.9 KB | ||
| その他 |  emd_19522_additional_1.map.gz emd_19522_additional_1.map.gz emd_19522_additional_2.map.gz emd_19522_additional_2.map.gz emd_19522_additional_3.map.gz emd_19522_additional_3.map.gz emd_19522_additional_4.map.gz emd_19522_additional_4.map.gz emd_19522_additional_5.map.gz emd_19522_additional_5.map.gz emd_19522_additional_6.map.gz emd_19522_additional_6.map.gz emd_19522_half_map_1.map.gz emd_19522_half_map_1.map.gz emd_19522_half_map_2.map.gz emd_19522_half_map_2.map.gz | 88.9 MB 165.3 MB 165.3 MB 140.4 MB 168.2 MB 105.4 MB 141.2 MB 141.1 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-19522 http://ftp.pdbj.org/pub/emdb/structures/EMD-19522 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-19522 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-19522 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_19522.map.gz / 形式: CCP4 / 大きさ: 178 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_19522.map.gz / 形式: CCP4 / 大きさ: 178 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Sharpened, local-resolution filtered cryo-EM density map of the formin INF2 bound to the barbed end of actin filaments. | ||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.9 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
+マスク #1
+マスク #2
+追加マップ: 3D-refined, unsharpened cryo-EM density map of INF2 bound...
+追加マップ: Unfiltered half map 1 of the formin INF2...
+追加マップ: Unfiltered half map 2 of the formin INF2...
+追加マップ: 3D-refined, unsharpened cryo-EM density map of the formin...
+追加マップ: Sharpened cryo-EM density map of the formin INF2...
+追加マップ: Composite map computed with the main map of...
+ハーフマップ: Unfiltered half map 1 of the formin INF2...
+ハーフマップ: Unfiltered half map 2 of the formin INF2...
- 試料の構成要素
試料の構成要素
-全体 : Complex of the formin INF2 dimer that binds to the actin subunits...
| 全体 | 名称: Complex of the formin INF2 dimer that binds to the actin subunits at the barbed end of actin filaments. |
|---|---|
| 要素 |
|
-超分子 #1: Complex of the formin INF2 dimer that binds to the actin subunits...
| 超分子 | 名称: Complex of the formin INF2 dimer that binds to the actin subunits at the barbed end of actin filaments. タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#2 詳細: Alpha actin was purified from rabbit skeletal muscle. INF2 was purified from E. coli. Actin filaments were co-polymerized in the presence of the formin INF2 prior to cryo-EM grid preparation. |
|---|
-超分子 #2: Actin filament barbed end
| 超分子 | 名称: Actin filament barbed end / タイプ: complex / ID: 2 / 親要素: 1 / 含まれる分子: #1 詳細: Complex of the actin subunits that form the barbed end of actin filaments. |
|---|---|
| 由来(天然) | 生物種:   Oryctolagus cuniculus (ウサギ) / 組織: Skeletal muscle Oryctolagus cuniculus (ウサギ) / 組織: Skeletal muscle |
-超分子 #3: INF2 dimer
| 超分子 | 名称: INF2 dimer / タイプ: complex / ID: 3 / 親要素: 1 / 含まれる分子: #2 詳細: This dimer is composed of the FH2 domain of the formin INF2. |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Actin, alpha skeletal muscle
| 分子 | 名称: Actin, alpha skeletal muscle / タイプ: protein_or_peptide / ID: 1 詳細: Rabbit skeletal alpha actin purified from frozen rabbit muscle acetone powder. コピー数: 4 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Oryctolagus cuniculus (ウサギ) / 組織: Skeletal muscle Oryctolagus cuniculus (ウサギ) / 組織: Skeletal muscle |
| 分子量 | 理論値: 41.875633 KDa |
| 配列 | 文字列: DEDETTALVC DNGSGLVKAG FAGDDAPRAV FPSIVGRPRH QGVMVGMGQK DSYVGDEAQS KRGILTLKYP IE(HIC)GII TNW DDMEKIWHHT FYNELRVAPE EHPTLLTEAP LNPKANREKM TQIMFETFNV PAMYVAIQAV LSLYASGRTT GIVLDSG DG ...文字列: DEDETTALVC DNGSGLVKAG FAGDDAPRAV FPSIVGRPRH QGVMVGMGQK DSYVGDEAQS KRGILTLKYP IE(HIC)GII TNW DDMEKIWHHT FYNELRVAPE EHPTLLTEAP LNPKANREKM TQIMFETFNV PAMYVAIQAV LSLYASGRTT GIVLDSG DG VTHNVPIYEG YALPHAIMRL DLAGRDLTDY LMKILTERGY SFVTTAEREI VRDIKEKLCY VALDFENEMA TAASSSSL E KSYELPDGQV ITIGNERFRC PETLFQPSFI GMESAGIHET TYNSIMKCDI DIRKDLYANN VMSGGTTMYP GIADRMQKE ITALAPSTMK IKIIAPPERK YSVWIGGSIL ASLSTFQQMW ITKQEYDEAG PSIVHRKCF UniProtKB:  Actin, alpha skeletal muscle Actin, alpha skeletal muscle |
-分子 #2: Isoform 2 of Inverted formin-2
| 分子 | 名称: Isoform 2 of Inverted formin-2 / タイプ: protein_or_peptide / ID: 2 詳細: INF2 FH1FH2C nonCAAX isoform was recombinantly expressed in E. coli BL21 Star pRARE cells and purified. This compound consists of the formin homology 1 and 2 domains, as well as the C- ...詳細: INF2 FH1FH2C nonCAAX isoform was recombinantly expressed in E. coli BL21 Star pRARE cells and purified. This compound consists of the formin homology 1 and 2 domains, as well as the C-terminal region of the human formin INF2 isoform nonCAAX. コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 84.453711 KDa |
| 組換発現 | 生物種:   Escherichia coli (大腸菌) Escherichia coli (大腸菌) |
| 配列 | 文字列: GGGGGMAPPA PPLPPPLPGS CEFLSPPPPP LPGLGCPPPP PPLLPGMGWG PPPPPPPLLP CTCSPPVAGG MEEVIVAQVD HGLGSAWVP SHRRVNPPTL RMKKLNWQKL PSNVAREHNS MWASLSSPDA EAVEPDFSSI ERLFSFPAAK PKEPTMVAPR A RKEPKEIT ...文字列: GGGGGMAPPA PPLPPPLPGS CEFLSPPPPP LPGLGCPPPP PPLLPGMGWG PPPPPPPLLP CTCSPPVAGG MEEVIVAQVD HGLGSAWVP SHRRVNPPTL RMKKLNWQKL PSNVAREHNS MWASLSSPDA EAVEPDFSSI ERLFSFPAAK PKEPTMVAPR A RKEPKEIT FLDAKKSLNL NIFLKQFKCS NEEVAAMIRA GDTTKFDVEV LKQLLKLLPE KHEIENLRAF TEERAKLASA DH FYLLLLA IPCYQLRIEC MLLCEGAAAV LDMVRPKAQL VLAACESLLT SRQLPIFCQL ILRIGNFLNY GSHTGDADGF KIS TLLKLT ETKSQQNRVT LLHHVLEEAE KSHPDLLQLP RDLEQPSQAA GINLEIIRSE ASSNLKKLLE TERKVSASVA EVQE QYTER LQASISAFRA LDELFEAIEQ KQRELADYLC EDAQQLSLED TFSTMKAFRD LFLRALKENK DRKEQAAKAE RRKQQ LAEE EARRPRGEDG KPVRKGPGKQ EEVCVIDALL ADIRKGFQLR KTARGRGDTD GGSKAASMDP PRATEPVATS NPAGDP VGS TRCPASEPGL DATTASESRG WDLVDAVTPG PQPTLEQLEE GGPRPLERRS SWYVDASDVL TTEDPQCPQP LEGAWPV TL GDAQALKPLK FSSNQPPAAG SSRQDAKDPT SLLGVLQAEA DSTSEGLEDA VHSRGARPPA AGPGGDEDED EEDTAPES A LDTSLDKSFS EDAVTDSSGS GTLPRARGRA SKGTGKRRKK RPSRSQEGLR PRPKAK UniProtKB: Inverted formin-2 |
-分子 #3: ADENOSINE-5'-DIPHOSPHATE
| 分子 | 名称: ADENOSINE-5'-DIPHOSPHATE / タイプ: ligand / ID: 3 / コピー数: 3 / 式: ADP |
|---|---|
| 分子量 | 理論値: 427.201 Da |
| Chemical component information | 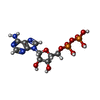 ChemComp-ADP: |
-分子 #4: MAGNESIUM ION
| 分子 | 名称: MAGNESIUM ION / タイプ: ligand / ID: 4 / コピー数: 4 / 式: MG |
|---|---|
| 分子量 | 理論値: 24.305 Da |
-分子 #5: PHOSPHATE ION
| 分子 | 名称: PHOSPHATE ION / タイプ: ligand / ID: 5 / コピー数: 1 / 式: PO4 |
|---|---|
| 分子量 | 理論値: 94.971 Da |
| Chemical component information | 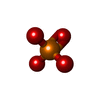 ChemComp-PO4: |
-分子 #6: ADENOSINE-5'-TRIPHOSPHATE
| 分子 | 名称: ADENOSINE-5'-TRIPHOSPHATE / タイプ: ligand / ID: 6 / コピー数: 1 / 式: ATP |
|---|---|
| 分子量 | 理論値: 507.181 Da |
| Chemical component information | 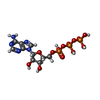 ChemComp-ATP: |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.1 構成要素:
詳細: 12 mM HEPES pH 7.1, 100 mM KCl, 2.1 mM MgCl2, 1 mM EGTA, 1 mM TCEP, 0.2 mM ATP | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| グリッド | モデル: Quantifoil R2/1 / 材質: GOLD / メッシュ: 200 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 90 sec. | |||||||||||||||||||||
| 凍結 | 凍結剤: ETHANE-PROPANE / チャンバー内湿度: 100 % / チャンバー内温度: 286 K / 装置: FEI VITROBOT MARK IV / 詳細: 3 seconds, force 0.. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 50.0 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.9 µm / 最小 デフォーカス(公称値): 1.3 µm / 倍率(公称値): 105000 Bright-field microscopy / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.9 µm / 最小 デフォーカス(公称値): 1.3 µm / 倍率(公称値): 105000 |
| 特殊光学系 | 球面収差補正装置: 300 kV Titan Krios G3 microscope (Thermo Fisher Scientific). エネルギーフィルター - 名称: GIF Bioquantum / エネルギーフィルター - スリット幅: 15 eV / 詳細: Gatan energy filter. |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 詳細 | 300 kV Titan Krios G3 microscope (Thermo Fisher Scientific). |
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 撮影したグリッド数: 1 / 実像数: 20305 / 平均電子線量: 60.6 e/Å2 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
-原子モデル構築 1
| 初期モデル |
| |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 詳細 | Real Space Refinement in Phenix. | |||||||||
| 精密化 | 空間: REAL / プロトコル: FLEXIBLE FIT | |||||||||
| 得られたモデル |  PDB-8rv2: |
 ムービー
ムービー コントローラー
コントローラー















 Z
Z Y
Y X
X