+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 8fvw | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | CryoEM structure of E.coli transcription elongation complex bound to ppGpp | ||||||||||||||||||
 要素 要素 |
| ||||||||||||||||||
 キーワード キーワード | TRANSCRIPTION/DNA/RNA / Transcription elongation / Second messager / ppGpp /  DNA repair (DNA修復) / TRANSCRIPTION-DNA-RNA complex DNA repair (DNA修復) / TRANSCRIPTION-DNA-RNA complex | ||||||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報 RNA polymerase complex / submerged biofilm formation / cellular response to cell envelope stress / cytosolic DNA-directed RNA polymerase complex / regulation of DNA-templated transcription initiation / bacterial-type flagellum assembly / bacterial-type flagellum-dependent cell motility / nitrate assimilation / transcription elongation factor complex / regulation of DNA-templated transcription elongation ... RNA polymerase complex / submerged biofilm formation / cellular response to cell envelope stress / cytosolic DNA-directed RNA polymerase complex / regulation of DNA-templated transcription initiation / bacterial-type flagellum assembly / bacterial-type flagellum-dependent cell motility / nitrate assimilation / transcription elongation factor complex / regulation of DNA-templated transcription elongation ... RNA polymerase complex / submerged biofilm formation / cellular response to cell envelope stress / cytosolic DNA-directed RNA polymerase complex / regulation of DNA-templated transcription initiation / bacterial-type flagellum assembly / bacterial-type flagellum-dependent cell motility / nitrate assimilation / transcription elongation factor complex / regulation of DNA-templated transcription elongation / transcription antitermination / RNA polymerase complex / submerged biofilm formation / cellular response to cell envelope stress / cytosolic DNA-directed RNA polymerase complex / regulation of DNA-templated transcription initiation / bacterial-type flagellum assembly / bacterial-type flagellum-dependent cell motility / nitrate assimilation / transcription elongation factor complex / regulation of DNA-templated transcription elongation / transcription antitermination /  運動性 / DNA-templated transcription initiation / 運動性 / DNA-templated transcription initiation /  ribonucleoside binding / DNA-directed 5'-3' RNA polymerase activity / ribonucleoside binding / DNA-directed 5'-3' RNA polymerase activity /  ポリメラーゼ / response to heat / protein-containing complex assembly / intracellular iron ion homeostasis / ポリメラーゼ / response to heat / protein-containing complex assembly / intracellular iron ion homeostasis /  protein dimerization activity / response to antibiotic / magnesium ion binding / protein dimerization activity / response to antibiotic / magnesium ion binding /  DNA binding / zinc ion binding / DNA binding / zinc ion binding /  生体膜 / 生体膜 /  細胞質基質 / 細胞質基質 /  細胞質 細胞質類似検索 - 分子機能 | ||||||||||||||||||
| 生物種 |   Escherichia coli K-12 (大腸菌) Escherichia coli K-12 (大腸菌)  Escherichia coli (大腸菌) Escherichia coli (大腸菌) | ||||||||||||||||||
| 手法 |  電子顕微鏡法 / 電子顕微鏡法 /  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 2.1 Å クライオ電子顕微鏡法 / 解像度: 2.1 Å | ||||||||||||||||||
 データ登録者 データ登録者 | Duan, W. / Serganov, A. | ||||||||||||||||||
| 資金援助 |  米国, 5件 米国, 5件
| ||||||||||||||||||
 引用 引用 |  ジャーナル: Nat Struct Mol Biol / 年: 2023 ジャーナル: Nat Struct Mol Biol / 年: 2023タイトル: Control of transcription elongation and DNA repair by alarmone ppGpp. 著者: Jacob W Weaver / Sergey Proshkin / Wenqian Duan / Vitaly Epshtein / Manjunath Gowder / Binod K Bharati / Elena Afanaseva / Alexander Mironov / Alexander Serganov / Evgeny Nudler /   要旨: Second messenger (p)ppGpp (collectively guanosine tetraphosphate and guanosine pentaphosphate) mediates bacterial adaptation to nutritional stress by modulating transcription initiation. More ...Second messenger (p)ppGpp (collectively guanosine tetraphosphate and guanosine pentaphosphate) mediates bacterial adaptation to nutritional stress by modulating transcription initiation. More recently, ppGpp has been implicated in coupling transcription and DNA repair; however, the mechanism of ppGpp engagement remained elusive. Here we present structural, biochemical and genetic evidence that ppGpp controls Escherichia coli RNA polymerase (RNAP) during elongation via a specific site that is nonfunctional during initiation. Structure-guided mutagenesis renders the elongation (but not initiation) complex unresponsive to ppGpp and increases bacterial sensitivity to genotoxic agents and ultraviolet radiation. Thus, ppGpp binds RNAP at sites with distinct functions in initiation and elongation, with the latter being important for promoting DNA repair. Our data provide insights on the molecular mechanism of ppGpp-mediated adaptation during stress, and further highlight the intricate relationships between genome stability, stress responses and transcription. | ||||||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  8fvw.cif.gz 8fvw.cif.gz | 661.2 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb8fvw.ent.gz pdb8fvw.ent.gz | 526 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  8fvw.json.gz 8fvw.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/fv/8fvw https://data.pdbj.org/pub/pdb/validation_reports/fv/8fvw ftp://data.pdbj.org/pub/pdb/validation_reports/fv/8fvw ftp://data.pdbj.org/pub/pdb/validation_reports/fv/8fvw | HTTPS FTP |
|---|
-関連構造データ
| 関連構造データ |  29494MC  8fvrC C: 同じ文献を引用 ( M: このデータのモデリングに利用したマップデータ |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-DNA-directed RNA polymerase subunit ... , 4種, 5分子 DEFGH
| #1: タンパク質 |  ポリメラーゼ / RNAP subunit alpha / RNA polymerase subunit alpha / Transcriptase subunit alpha ポリメラーゼ / RNAP subunit alpha / RNA polymerase subunit alpha / Transcriptase subunit alpha分子量: 36558.680 Da / 分子数: 2 / 由来タイプ: 組換発現 / 由来: (組換発現)   Escherichia coli K-12 (大腸菌) / 遺伝子: rpoA, pez, phs, sez, b3295, JW3257 / 発現宿主: Escherichia coli K-12 (大腸菌) / 遺伝子: rpoA, pez, phs, sez, b3295, JW3257 / 発現宿主:   Escherichia coli BL21(DE3) (大腸菌) / 参照: UniProt: P0A7Z4, Escherichia coli BL21(DE3) (大腸菌) / 参照: UniProt: P0A7Z4,  ポリメラーゼ ポリメラーゼ#2: タンパク質 | |  ポリメラーゼ / RNAP subunit beta / RNA polymerase subunit beta / Transcriptase subunit beta ポリメラーゼ / RNAP subunit beta / RNA polymerase subunit beta / Transcriptase subunit beta分子量: 150820.875 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)   Escherichia coli K-12 (大腸菌) Escherichia coli K-12 (大腸菌)遺伝子: rpoB, groN, nitB, rif, ron, stl, stv, tabD, b3987, JW3950 発現宿主:   Escherichia coli BL21(DE3) (大腸菌) / 参照: UniProt: P0A8V2, Escherichia coli BL21(DE3) (大腸菌) / 参照: UniProt: P0A8V2,  ポリメラーゼ ポリメラーゼ#3: タンパク質 | |  ポリメラーゼ / RNAP subunit beta' / RNA polymerase subunit beta' / Transcriptase subunit beta' ポリメラーゼ / RNAP subunit beta' / RNA polymerase subunit beta' / Transcriptase subunit beta'分子量: 156504.969 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)   Escherichia coli K-12 (大腸菌) / 遺伝子: rpoC, tabB, b3988, JW3951 / 発現宿主: Escherichia coli K-12 (大腸菌) / 遺伝子: rpoC, tabB, b3988, JW3951 / 発現宿主:   Escherichia coli BL21(DE3) (大腸菌) / 参照: UniProt: P0A8T7, Escherichia coli BL21(DE3) (大腸菌) / 参照: UniProt: P0A8T7,  ポリメラーゼ ポリメラーゼ#4: タンパク質 | |  ポリメラーゼ / RNAP omega subunit / RNA polymerase omega subunit / Transcriptase subunit omega ポリメラーゼ / RNAP omega subunit / RNA polymerase omega subunit / Transcriptase subunit omega分子量: 10249.547 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)   Escherichia coli K-12 (大腸菌) / 遺伝子: rpoZ, b3649, JW3624 / 発現宿主: Escherichia coli K-12 (大腸菌) / 遺伝子: rpoZ, b3649, JW3624 / 発現宿主:   Escherichia coli BL21(DE3) (大腸菌) / 参照: UniProt: P0A800, Escherichia coli BL21(DE3) (大腸菌) / 参照: UniProt: P0A800,  ポリメラーゼ ポリメラーゼ |
|---|
-DNA鎖 , 2種, 2分子 AB
| #5: DNA鎖 | 分子量: 16211.382 Da / 分子数: 1 / 由来タイプ: 合成 / 由来: (合成)   Escherichia coli (大腸菌) Escherichia coli (大腸菌) |
|---|---|
| #7: DNA鎖 | 分子量: 16269.433 Da / 分子数: 1 / 由来タイプ: 合成 / 由来: (合成)   Escherichia coli (大腸菌) Escherichia coli (大腸菌) |
-RNA鎖 , 1種, 1分子 C
| #6: RNA鎖 | 分子量: 5224.208 Da / 分子数: 1 / 由来タイプ: 合成 / 由来: (合成)   Escherichia coli (大腸菌) Escherichia coli (大腸菌) |
|---|
-非ポリマー , 5種, 231分子 



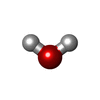




| #8: 化合物 | ChemComp-G4P /  Guanosine pentaphosphate Guanosine pentaphosphate | ||||||
|---|---|---|---|---|---|---|---|
| #9: 化合物 | | #10: 化合物 | #11: 化合物 | ChemComp-NA / | #12: 水 | ChemComp-HOH / |  水 水 |
-詳細
| 研究の焦点であるリガンドがあるか | Y |
|---|
-実験情報
-実験
| 実験 | 手法:  電子顕微鏡法 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法:  単粒子再構成法 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: E. coli transcription elongation complex bound to ppGpp (EC-ppGpp) タイプ: COMPLEX / Entity ID: #1-#7 / 由来: MULTIPLE SOURCES | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 由来(天然) |
| ||||||||||||
| 由来(組換発現) | 生物種:   Escherichia coli BL21(DE3) (大腸菌) Escherichia coli BL21(DE3) (大腸菌) | ||||||||||||
| 緩衝液 | pH: 8 詳細: 20 mM HEPES, pH 8.0, 150 mM NaCl, 10 mM MgCl2, 10 uM ZnCl2, 5 mM DTT | ||||||||||||
| 試料 | 濃度: 6.5 mg/ml / 包埋: NO / シャドウイング: NO / 染色 : NO / 凍結 : NO / 凍結 : YES : YES詳細: Elongation Complex was mixed with 0.1 mM ppGpp (TriLink) for 20 min at room temperature followed by addition of 8 mM CHAPSO. | ||||||||||||
| 試料支持 | グリッドの材料: GOLD / グリッドのサイズ: 300 divisions/in. / グリッドのタイプ: Quantifoil R1.2/1.3 | ||||||||||||
急速凍結 | 装置: FEI VITROBOT MARK IV / 凍結剤: ETHANE / 湿度: 100 % / 凍結前の試料温度: 283.15 K |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源 : :  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD Bright-field microscopy / 倍率(公称値): 105000 X / 最大 デフォーカス(公称値): 1900 nm / 最小 デフォーカス(公称値): 900 nm / Cs Bright-field microscopy / 倍率(公称値): 105000 X / 最大 デフォーカス(公称値): 1900 nm / 最小 デフォーカス(公称値): 900 nm / Cs : 2.7 mm / C2レンズ絞り径: 70 µm / アライメント法: COMA FREE : 2.7 mm / C2レンズ絞り径: 70 µm / アライメント法: COMA FREE |
| 試料ホルダ | 凍結剤: NITROGEN 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER 最高温度: 79.95 K / 最低温度: 79.95 K / Residual tilt: 0.05 mradians |
| 撮影 | 平均露光時間: 2 sec. / 電子線照射量: 57.54 e/Å2 フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 撮影したグリッド数: 1 / 実像数: 4921 |
| 電子光学装置 | エネルギーフィルター名称 : GIF Bioquantum / エネルギーフィルタースリット幅: 20 eV : GIF Bioquantum / エネルギーフィルタースリット幅: 20 eV |
| 画像スキャン | サンプリングサイズ: 5 µm / 横: 5760 / 縦: 4092 |
- 解析
解析
| ソフトウェア | 名称: PHENIX / バージョン: 1.20.1_4487: / 分類: 精密化 | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| EMソフトウェア |
| ||||||||||||||||||||||||||||||||||||
CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||||||||||||||
| 粒子像の選択 | 選択した粒子像数: 1001665 詳細: In total, 1,001,665 particles were picked in template-free mode | ||||||||||||||||||||||||||||||||||||
| 対称性 | 点対称性 : C1 (非対称) : C1 (非対称) | ||||||||||||||||||||||||||||||||||||
3次元再構成 | 解像度: 2.1 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 643682 / クラス平均像の数: 30 / 対称性のタイプ: POINT | ||||||||||||||||||||||||||||||||||||
| 原子モデル構築 | プロトコル: RIGID BODY FIT | ||||||||||||||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー



 PDBj
PDBj