+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 7w52 | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | Crystal structure of fragmin domain-1 (15-160) in complex with actin | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード |  CONTRACTILE PROTEIN / actin dynamics / CONTRACTILE PROTEIN / actin dynamics /  fragmin (ダルテパリン) / fragmin (ダルテパリン) /  gelsolin / gelsolin /  ATP hydrolysis ATP hydrolysis | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Striated Muscle Contraction / skeletal muscle thin filament assembly / striated muscle thin filament / skeletal muscle fiber development /  stress fiber / stress fiber /  マイクロフィラメント / マイクロフィラメント /  加水分解酵素; 酸無水物に作用; 酸無水物に作用・細胞または細胞小器官の運動に関与 / 加水分解酵素; 酸無水物に作用; 酸無水物に作用・細胞または細胞小器官の運動に関与 /  actin filament binding / actin filament binding /  hydrolase activity / hydrolase activity /  ATP binding ATP binding類似検索 - 分子機能 | ||||||
| 生物種 |   Physarum polycephalum (モジホコリ) Physarum polycephalum (モジホコリ)  Gallus gallus (ニワトリ) Gallus gallus (ニワトリ) | ||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 2.001 Å 分子置換 / 解像度: 2.001 Å | ||||||
 データ登録者 データ登録者 | Takeda, S. | ||||||
| 資金援助 |  日本, 1件 日本, 1件
| ||||||
 引用 引用 |  ジャーナル: Proc.Natl.Acad.Sci.USA / 年: 2022 ジャーナル: Proc.Natl.Acad.Sci.USA / 年: 2022タイトル: Structures and mechanisms of actin ATP hydrolysis. 著者: Kanematsu, Y. / Narita, A. / Oda, T. / Koike, R. / Ota, M. / Takano, Y. / Moritsugu, K. / Fujiwara, I. / Tanaka, K. / Komatsu, H. / Nagae, T. / Watanabe, N. / Iwasa, M. / Maeda, Y. / Takeda, S. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  7w52.cif.gz 7w52.cif.gz | 440.3 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb7w52.ent.gz pdb7w52.ent.gz | 351.7 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  7w52.json.gz 7w52.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/w5/7w52 https://data.pdbj.org/pub/pdb/validation_reports/w5/7w52 ftp://data.pdbj.org/pub/pdb/validation_reports/w5/7w52 ftp://data.pdbj.org/pub/pdb/validation_reports/w5/7w52 | HTTPS FTP |
|---|
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||
| 2 | 
| ||||||||
| 3 | 
| ||||||||
| 4 | 
| ||||||||
| 単位格子 |
|
- 要素
要素
-タンパク質 , 2種, 8分子 ACEGBDFH
| #1: タンパク質 |  / Alpha-actin-1 / Alpha-actin-1分子量: 42109.973 Da / 分子数: 4 / 由来タイプ: 天然 / 由来: (天然)   Gallus gallus (ニワトリ) / 参照: UniProt: P68139 Gallus gallus (ニワトリ) / 参照: UniProt: P68139#2: タンパク質 | 分子量: 16587.561 Da / 分子数: 4 / 由来タイプ: 組換発現 詳細: the first two residues (GP) were derived from expression tag 由来: (組換発現)   Physarum polycephalum (モジホコリ) Physarum polycephalum (モジホコリ)発現宿主:   Escherichia coli (大腸菌) / 参照: UniProt: Q94707 Escherichia coli (大腸菌) / 参照: UniProt: Q94707 |
|---|
-非ポリマー , 6種, 1516分子 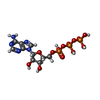

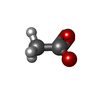

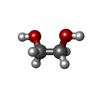






| #3: 化合物 | ChemComp-ATP /  アデノシン三リン酸 アデノシン三リン酸#4: 化合物 | ChemComp-CA / #5: 化合物 | ChemComp-ACT /  酢酸塩 酢酸塩#6: 化合物 | ChemComp-NA / #7: 化合物 | ChemComp-EDO /  エチレングリコール エチレングリコール#8: 水 | ChemComp-HOH / |  水 水 |
|---|
-詳細
| 研究の焦点であるリガンドがあるか | Y |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.49 Å3/Da / 溶媒含有率: 50.67 % |
|---|---|
結晶化 | 温度: 293 K / 手法: 蒸気拡散法, ハンギングドロップ法 詳細: 0.1 M sodium acetate, pH 4.5, 0.1 M calcium acetate, and 7% PEG3350 |
-データ収集
| 回折 | 平均測定温度: 95 K / Serial crystal experiment: N | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: AichiSR シンクロトロン / サイト: AichiSR  / ビームライン: BL2S1 / 波長: 1.12 Å / ビームライン: BL2S1 / 波長: 1.12 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 検出器 | タイプ: ADSC QUANTUM 315r / 検出器: CCD / 日付: 2017年5月31日 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 放射波長 | 波長 : 1.12 Å / 相対比: 1 : 1.12 Å / 相対比: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 反射 | 解像度: 2→46.673 Å / Num. obs: 157109 / % possible obs: 98.2 % / 冗長度: 6.568 % / Biso Wilson estimate: 42.022 Å2 / CC1/2: 0.999 / Rmerge(I) obs: 0.074 / Rrim(I) all: 0.081 / Χ2: 1.074 / Net I/σ(I): 17.42 / Num. measured all: 1031833 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 反射 シェル | Diffraction-ID: 1
|
-位相決定
位相決定 | 手法:  分子置換 分子置換 |
|---|
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法 : :  分子置換 分子置換開始モデル: 1P8Z 解像度: 2.001→46.673 Å / SU ML: 0.28 / 交差検証法: THROUGHOUT / σ(F): 1.34 / 位相誤差: 25.7 / 立体化学のターゲット値: ML
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | 減衰半径: 0.9 Å / VDWプローブ半径: 1.11 Å / 溶媒モデル: FLAT BULK SOLVENT MODEL | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso max: 109.23 Å2 / Biso mean: 42.3089 Å2 / Biso min: 16.93 Å2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: final / 解像度: 2.001→46.673 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | Refine-ID: X-RAY DIFFRACTION / Rfactor Rfree error: 0
|
 ムービー
ムービー コントローラー
コントローラー








 PDBj
PDBj







