+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 5gam | ||||||
|---|---|---|---|---|---|---|---|
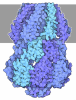
| タイトル | Foot region of the yeast spliceosomal U4/U6.U5 tri-snRNP | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード |  TRANSCRIPTION (転写 (生物学)) / pre-mRNA splicing / TRANSCRIPTION (転写 (生物学)) / pre-mRNA splicing /  snRNP (核内低分子リボ核タンパク質) / snRNP (核内低分子リボ核タンパク質) /  GTPase (GTPアーゼ) / GTPase (GTPアーゼ) /  U5 snRNA (U5 snRNA) / U5 snRNA (U5 snRNA) /  Prp8 (Prp8) / Prp8 (Prp8) /  spliceosome (スプライセオソーム) spliceosome (スプライセオソーム) | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報generation of catalytic spliceosome for first transesterification step /  splicing factor binding / spliceosome conformational change to release U4 (or U4atac) and U1 (or U11) / U4/U6 snRNP / 7-methylguanosine cap hypermethylation / pICln-Sm protein complex / splicing factor binding / spliceosome conformational change to release U4 (or U4atac) and U1 (or U11) / U4/U6 snRNP / 7-methylguanosine cap hypermethylation / pICln-Sm protein complex /  small nuclear ribonucleoprotein complex / SMN-Sm protein complex / spliceosomal tri-snRNP complex / commitment complex ...generation of catalytic spliceosome for first transesterification step / small nuclear ribonucleoprotein complex / SMN-Sm protein complex / spliceosomal tri-snRNP complex / commitment complex ...generation of catalytic spliceosome for first transesterification step /  splicing factor binding / spliceosome conformational change to release U4 (or U4atac) and U1 (or U11) / U4/U6 snRNP / 7-methylguanosine cap hypermethylation / pICln-Sm protein complex / splicing factor binding / spliceosome conformational change to release U4 (or U4atac) and U1 (or U11) / U4/U6 snRNP / 7-methylguanosine cap hypermethylation / pICln-Sm protein complex /  small nuclear ribonucleoprotein complex / SMN-Sm protein complex / spliceosomal tri-snRNP complex / commitment complex / U2-type prespliceosome assembly / U2-type catalytic step 2 spliceosome / poly(U) RNA binding / U4 snRNP / U2 snRNP / U1 snRNP / U2-type prespliceosome / precatalytic spliceosome / spliceosomal complex assembly / generation of catalytic spliceosome for second transesterification step / mRNA 5'-splice site recognition / mRNA 3'-splice site recognition / spliceosomal tri-snRNP complex assembly / small nuclear ribonucleoprotein complex / SMN-Sm protein complex / spliceosomal tri-snRNP complex / commitment complex / U2-type prespliceosome assembly / U2-type catalytic step 2 spliceosome / poly(U) RNA binding / U4 snRNP / U2 snRNP / U1 snRNP / U2-type prespliceosome / precatalytic spliceosome / spliceosomal complex assembly / generation of catalytic spliceosome for second transesterification step / mRNA 5'-splice site recognition / mRNA 3'-splice site recognition / spliceosomal tri-snRNP complex assembly /  U5 snRNA binding / U5 snRNP / U5 snRNA binding / U5 snRNP /  U2 snRNA binding / U2 snRNA binding /  U6 snRNA binding / spliceosomal snRNP assembly / pre-mRNA intronic binding / U6 snRNA binding / spliceosomal snRNP assembly / pre-mRNA intronic binding /  U1 snRNA binding / U4/U6 x U5 tri-snRNP complex / catalytic step 2 spliceosome / U1 snRNA binding / U4/U6 x U5 tri-snRNP complex / catalytic step 2 spliceosome /  spliceosomal complex / spliceosomal complex /  mRNA splicing, via spliceosome / mRNA splicing, via spliceosome /  metallopeptidase activity / metallopeptidase activity /  mRNA binding / mRNA binding /  GTPase activity / GTP binding / GTPase activity / GTP binding /  RNA binding / RNA binding /  細胞核 / 細胞核 /  細胞質基質 / 細胞質基質 /  細胞質 細胞質類似検索 - 分子機能 | ||||||
| 生物種 |   Saccharomyces cerevisiae (パン酵母) Saccharomyces cerevisiae (パン酵母) | ||||||
| 手法 |  電子顕微鏡法 / 電子顕微鏡法 /  単粒子再構成法 / 解像度: 3.7 Å 単粒子再構成法 / 解像度: 3.7 Å | ||||||
 データ登録者 データ登録者 | Nguyen, T.H.D. / Galej, W.P. / Bai, X.C. / Oubridge, C. / Scheres, S.H.W. / Newman, A.J. / Nagai, K. | ||||||
| 資金援助 |  英国, 1件 英国, 1件
| ||||||
 引用 引用 |  ジャーナル: Nature / 年: 2016 ジャーナル: Nature / 年: 2016タイトル: Cryo-EM structure of the yeast U4/U6.U5 tri-snRNP at 3.7 Å resolution. 著者: Thi Hoang Duong Nguyen / Wojciech P Galej / Xiao-Chen Bai / Chris Oubridge / Andrew J Newman / Sjors H W Scheres / Kiyoshi Nagai /  要旨: U4/U6.U5 tri-snRNP represents a substantial part of the spliceosome before activation. A cryo-electron microscopy structure of Saccharomyces cerevisiae U4/U6.U5 tri-snRNP at 3.7 Å resolution led ...U4/U6.U5 tri-snRNP represents a substantial part of the spliceosome before activation. A cryo-electron microscopy structure of Saccharomyces cerevisiae U4/U6.U5 tri-snRNP at 3.7 Å resolution led to an essentially complete atomic model comprising 30 proteins plus U4/U6 and U5 small nuclear RNAs (snRNAs). The structure reveals striking interweaving interactions of the protein and RNA components, including extended polypeptides penetrating into subunit interfaces. The invariant ACAGAGA sequence of U6 snRNA, which base-pairs with the 5'-splice site during catalytic activation, forms a hairpin stabilized by Dib1 and Prp8 while the adjacent nucleotides interact with the exon binding loop 1 of U5 snRNA. Snu114 harbours GTP, but its putative catalytic histidine is held away from the γ-phosphate by hydrogen bonding to a tyrosine in the amino-terminal domain of Prp8. Mutation of this histidine to alanine has no detectable effect on yeast growth. The structure provides important new insights into the spliceosome activation process leading to the formation of the catalytic centre. #1:  ジャーナル: Nature / 年: 2015 ジャーナル: Nature / 年: 2015タイトル: The architecture of the spliceosomal U4/U6.U5 tri-snRNP. 著者: Thi Hoang Duong Nguyen / Wojciech P Galej / Xiao-chen Bai / Christos G Savva / Andrew J Newman / Sjors H W Scheres / Kiyoshi Nagai /  要旨: U4/U6.U5 tri-snRNP is a 1.5-megadalton pre-assembled spliceosomal complex comprising U5 small nuclear RNA (snRNA), extensively base-paired U4/U6 snRNAs and more than 30 proteins, including the key ...U4/U6.U5 tri-snRNP is a 1.5-megadalton pre-assembled spliceosomal complex comprising U5 small nuclear RNA (snRNA), extensively base-paired U4/U6 snRNAs and more than 30 proteins, including the key components Prp8, Brr2 and Snu114. The tri-snRNP combines with a precursor messenger RNA substrate bound to U1 and U2 small nuclear ribonucleoprotein particles (snRNPs), and transforms into a catalytically active spliceosome after extensive compositional and conformational changes triggered by unwinding of the U4 and U6 (U4/U6) snRNAs. Here we use cryo-electron microscopy single-particle reconstruction of Saccharomyces cerevisiae tri-snRNP at 5.9 Å resolution to reveal the essentially complete organization of its RNA and protein components. The single-stranded region of U4 snRNA between its 3' stem-loop and the U4/U6 snRNA stem I is loaded into the Brr2 helicase active site ready for unwinding. Snu114 and the amino-terminal domain of Prp8 position U5 snRNA to insert its loop I, which aligns the exons for splicing, into the Prp8 active site cavity. The structure provides crucial insights into the activation process and the active site of the spliceosome. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  5gam.cif.gz 5gam.cif.gz | 506.9 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb5gam.ent.gz pdb5gam.ent.gz | 387.6 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  5gam.json.gz 5gam.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/ga/5gam https://data.pdbj.org/pub/pdb/validation_reports/ga/5gam ftp://data.pdbj.org/pub/pdb/validation_reports/ga/5gam ftp://data.pdbj.org/pub/pdb/validation_reports/ga/5gam | HTTPS FTP |
|---|
-関連構造データ
| 関連構造データ |  8011MC  8006C  8007C  8008C  8009C  8010C  8012C  8013C  8014C  5ganC  5gaoC  5gapC M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-RNA鎖 , 2種, 2分子 UW
| #1: RNA鎖 |  分子量: 57138.711 Da / 分子数: 1 / 由来タイプ: 天然 / 詳細: Short form of U5 snRNA (179 nt) / 由来: (天然)   Saccharomyces cerevisiae (パン酵母) / 株: BCY123 / 参照: GenBank: 807071959 Saccharomyces cerevisiae (パン酵母) / 株: BCY123 / 参照: GenBank: 807071959 |
|---|---|
| #4: RNA鎖 |  分子量: 9928.893 Da / 分子数: 1 / 由来タイプ: 天然 / 詳細: The 5' end 31 nucleotides of U6 snRNA / 由来: (天然)   Saccharomyces cerevisiae (パン酵母) / 株: BCY123 Saccharomyces cerevisiae (パン酵母) / 株: BCY123 |
-Pre-mRNA-splicing factor ... , 2種, 2分子 AC
| #2: タンパク質 | 分子量: 85826.102 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)   Saccharomyces cerevisiae (パン酵母) / 株: BCY123 / 参照: UniProt: P33334 Saccharomyces cerevisiae (パン酵母) / 株: BCY123 / 参照: UniProt: P33334 |
|---|---|
| #3: タンパク質 | 分子量: 114132.086 Da / 分子数: 1 / 由来タイプ: 天然 / 詳細: Full length Snu114 / 由来: (天然)   Saccharomyces cerevisiae (パン酵母) / 株: BCY123 / 参照: UniProt: P36048 Saccharomyces cerevisiae (パン酵母) / 株: BCY123 / 参照: UniProt: P36048 |
-Small nuclear ribonucleoprotein ... , 6種, 6分子 efgdhj
| #6: タンパク質 | 分子量: 10385.098 Da / 分子数: 1 / 由来タイプ: 天然 / 詳細: The SmE protein from the U5 snRNP Sm protein ring. / 由来: (天然)   Saccharomyces cerevisiae (パン酵母) / 株: BCY123 / 参照: UniProt: Q12330 Saccharomyces cerevisiae (パン酵母) / 株: BCY123 / 参照: UniProt: Q12330 |
|---|---|
| #7: タンパク質 | 分子量: 9669.945 Da / 分子数: 1 / 由来タイプ: 天然 / 詳細: The SmF protein from the U5 snRNP Sm protein ring. / 由来: (天然)   Saccharomyces cerevisiae (パン酵母) / 株: BCY123 / 参照: UniProt: P54999 Saccharomyces cerevisiae (パン酵母) / 株: BCY123 / 参照: UniProt: P54999 |
| #8: タンパク質 | 分子量: 8490.809 Da / 分子数: 1 / 由来タイプ: 天然 / 詳細: The SmG protein from the U5 snRNP Sm protein ring. / 由来: (天然)   Saccharomyces cerevisiae (パン酵母) / 株: BCY123 / 参照: UniProt: P40204 Saccharomyces cerevisiae (パン酵母) / 株: BCY123 / 参照: UniProt: P40204 |
| #10: タンパク質 | 分子量: 11240.139 Da / 分子数: 1 / 由来タイプ: 天然 / 詳細: The SmD3 protein from the U5 snRNP Sm protein ring. / 由来: (天然)   Saccharomyces cerevisiae (パン酵母) / 株: BCY123 / 参照: UniProt: P43321 Saccharomyces cerevisiae (パン酵母) / 株: BCY123 / 参照: UniProt: P43321 |
| #11: タンパク質 | 分子量: 16296.798 Da / 分子数: 1 / 由来タイプ: 天然 / 詳細: The SmD1 protein from the U5 snRNP Sm protein ring. / 由来: (天然)   Saccharomyces cerevisiae (パン酵母) / 株: BCY123 / 参照: UniProt: Q02260 Saccharomyces cerevisiae (パン酵母) / 株: BCY123 / 参照: UniProt: Q02260 |
| #12: タンパク質 | 分子量: 12876.066 Da / 分子数: 1 / 由来タイプ: 天然 / 詳細: The SmD2 protein from the U5 snRNP Sm protein ring. / 由来: (天然)   Saccharomyces cerevisiae (パン酵母) / 株: BCY123 / 参照: UniProt: Q06217 Saccharomyces cerevisiae (パン酵母) / 株: BCY123 / 参照: UniProt: Q06217 |
-タンパク質 / タンパク質・ペプチド / 非ポリマー , 3種, 3分子 bx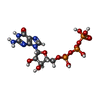

| #13: 化合物 | ChemComp-GTP /  グアノシン三リン酸 グアノシン三リン酸 |
|---|---|
| #5: タンパク質 | 分子量: 22426.990 Da / 分子数: 1 / 由来タイプ: 天然 / 詳細: The SmB protein from the U5 snRNP Sm protein ring. / 由来: (天然)   Saccharomyces cerevisiae (パン酵母) / 株: BCY123 / 参照: UniProt: P40018 Saccharomyces cerevisiae (パン酵母) / 株: BCY123 / 参照: UniProt: P40018 |
| #9: タンパク質・ペプチド | 分子量: 1549.902 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)   Saccharomyces cerevisiae (パン酵母) / 株: BCY123 Saccharomyces cerevisiae (パン酵母) / 株: BCY123 |
-実験情報
-実験
| 実験 | 手法:  電子顕微鏡法 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法:  単粒子再構成法 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: Foot region of the yeast spliceosomal U4/U6.U5 tri-snRNP タイプ: COMPLEX / Entity ID: #1-#12 / 由来: NATURAL | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 分子量 | 値: 0.35 MDa | |||||||||||||||||||||||||
| 由来(天然) | 生物種:   Saccharomyces cerevisiae (パン酵母) / 株: BCY123 Saccharomyces cerevisiae (パン酵母) / 株: BCY123 | |||||||||||||||||||||||||
| 緩衝液 | pH: 7.9 | |||||||||||||||||||||||||
| 緩衝液成分 |
| |||||||||||||||||||||||||
| 試料 | 濃度: 0.2 mg/ml / 包埋: NO / シャドウイング: NO / 染色 : NO / 凍結 : NO / 凍結 : NO : NO | |||||||||||||||||||||||||
| 試料支持 | 詳細: Grids are made of holey carbon, carbon-coated and glow discharged in N-amylamine. グリッドの材料: COPPER / グリッドのサイズ: 400 divisions/in. / グリッドのタイプ: Quantifoil R1.2/1.3 |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源 : :  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD Bright-field microscopy / 倍率(公称値): 81000 X / 倍率(補正後): 35714 X / 最大 デフォーカス(公称値): 3500 nm / 最小 デフォーカス(公称値): 500 nm / Cs Bright-field microscopy / 倍率(公称値): 81000 X / 倍率(補正後): 35714 X / 最大 デフォーカス(公称値): 3500 nm / 最小 デフォーカス(公称値): 500 nm / Cs : 2 mm : 2 mm |
| 試料ホルダ | 凍結剤: NITROGEN 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER |
| 撮影 | 平均露光時間: 16 sec. / 電子線照射量: 38 e/Å2 / 検出モード: SUPER-RESOLUTION フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 実像数: 2477 |
| 電子光学装置 | エネルギーフィルター名称 : GIF Quantum : GIF Quantum |
| 画像スキャン | 動画フレーム数/画像: 20 / 利用したフレーム数/画像: 1-20 |
- 解析
解析
| ソフトウェア | 名称: REFMAC / バージョン: 5.8.0124 / 分類: 精密化 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| EMソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
CTF補正 | タイプ: PHASE FLIPPING ONLY | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 粒子像の選択 | 選択した粒子像数: 473827 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 点対称性 : C1 (非対称) : C1 (非対称) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3次元再構成 | 解像度: 3.7 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 140155 / クラス平均像の数: 1 / 対称性のタイプ: POINT | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子モデル構築 | 空間: RECIPROCAL | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 | 解像度: 3.7→154.44 Å / Cor.coef. Fo:Fc: 0.971 / SU B: 29.01 / SU ML: 0.411 / ESU R: 0.682 立体化学のターゲット値: MAXIMUM LIKELIHOOD WITH PHASES 詳細: HYDROGENS HAVE BEEN ADDED IN THE RIDING POSITIONS /
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | 溶媒モデル: PARAMETERS FOR MASK CACLULATION | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 382.847 Å2
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー










 PDBj
PDBj