+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 2pnn | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | Crystal Structure of the Ankyrin Repeat Domain of Trpv1 | ||||||
 要素 要素 | Transient receptor potential cation channel subfamily V member 1 TRPV1 TRPV1 | ||||||
 キーワード キーワード |  TRANSPORT PROTEIN (運搬体タンパク質) / TRANSPORT PROTEIN (運搬体タンパク質) /  trpv1 (TRPV1) / trpv1 (TRPV1) /  ankyrin repeat domain ankyrin repeat domain | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報temperature-gated ion channel activity / response to capsazepine / excitatory extracellular ligand-gated monoatomic ion channel activity / negative regulation of establishment of blood-brain barrier / sensory perception of mechanical stimulus / peptide secretion / urinary bladder smooth muscle contraction / detection of chemical stimulus involved in sensory perception of pain / cellular response to temperature stimulus / smooth muscle contraction involved in micturition ...temperature-gated ion channel activity / response to capsazepine / excitatory extracellular ligand-gated monoatomic ion channel activity / negative regulation of establishment of blood-brain barrier / sensory perception of mechanical stimulus / peptide secretion / urinary bladder smooth muscle contraction / detection of chemical stimulus involved in sensory perception of pain / cellular response to temperature stimulus / smooth muscle contraction involved in micturition /  TRPチャネル / cellular response to acidic pH / TRPチャネル / cellular response to acidic pH /  thermoception / fever generation / detection of temperature stimulus involved in thermoception / glutamate secretion / dendritic spine membrane / negative regulation of systemic arterial blood pressure / chloride channel regulator activity / response to pH / monoatomic cation transmembrane transporter activity / cellular response to ATP / response to pain / thermoception / fever generation / detection of temperature stimulus involved in thermoception / glutamate secretion / dendritic spine membrane / negative regulation of systemic arterial blood pressure / chloride channel regulator activity / response to pH / monoatomic cation transmembrane transporter activity / cellular response to ATP / response to pain /  temperature homeostasis / negative regulation of heart rate / cellular response to alkaloid / behavioral response to pain / diet induced thermogenesis / extracellular ligand-gated monoatomic ion channel activity / intracellularly gated calcium channel activity / cellular response to cytokine stimulus / negative regulation of mitochondrial membrane potential / detection of temperature stimulus involved in sensory perception of pain / calcium ion import across plasma membrane / ligand-gated monoatomic ion channel activity / monoatomic cation channel activity / sensory perception of pain / response to organonitrogen compound / temperature homeostasis / negative regulation of heart rate / cellular response to alkaloid / behavioral response to pain / diet induced thermogenesis / extracellular ligand-gated monoatomic ion channel activity / intracellularly gated calcium channel activity / cellular response to cytokine stimulus / negative regulation of mitochondrial membrane potential / detection of temperature stimulus involved in sensory perception of pain / calcium ion import across plasma membrane / ligand-gated monoatomic ion channel activity / monoatomic cation channel activity / sensory perception of pain / response to organonitrogen compound /  phosphatidylinositol binding / monoatomic ion transmembrane transport / cellular response to nerve growth factor stimulus / phosphatidylinositol binding / monoatomic ion transmembrane transport / cellular response to nerve growth factor stimulus /  phosphoprotein binding / calcium ion transmembrane transport / microglial cell activation / phosphoprotein binding / calcium ion transmembrane transport / microglial cell activation /  calcium channel activity / lipid metabolic process / response to peptide hormone / cellular response to growth factor stimulus / positive regulation of nitric oxide biosynthetic process / calcium ion transport / transmembrane signaling receptor activity / cellular response to heat / cellular response to tumor necrosis factor / positive regulation of cytosolic calcium ion concentration / response to heat / calcium channel activity / lipid metabolic process / response to peptide hormone / cellular response to growth factor stimulus / positive regulation of nitric oxide biosynthetic process / calcium ion transport / transmembrane signaling receptor activity / cellular response to heat / cellular response to tumor necrosis factor / positive regulation of cytosolic calcium ion concentration / response to heat /  postsynaptic membrane / protein homotetramerization / postsynaptic membrane / protein homotetramerization /  calmodulin binding / neuron projection / positive regulation of apoptotic process / external side of plasma membrane / neuronal cell body / calmodulin binding / neuron projection / positive regulation of apoptotic process / external side of plasma membrane / neuronal cell body /  樹状突起 / negative regulation of transcription by RNA polymerase II / 樹状突起 / negative regulation of transcription by RNA polymerase II /  ATP binding / ATP binding /  生体膜 / identical protein binding / 生体膜 / identical protein binding /  metal ion binding / metal ion binding /  細胞膜 細胞膜類似検索 - 分子機能 | ||||||
| 生物種 |   Rattus norvegicus (ドブネズミ) Rattus norvegicus (ドブネズミ) | ||||||
| 手法 |  X線回折 / X線回折 /  分子置換 / 解像度: 2.7 Å 分子置換 / 解像度: 2.7 Å | ||||||
 データ登録者 データ登録者 | Jin, X. / Gaudet, R. | ||||||
 引用 引用 |  ジャーナル: Neuron / 年: 2007 ジャーナル: Neuron / 年: 2007タイトル: The Ankyrin Repeats of TRPV1 Bind Multiple Ligands and Modulate Channel Sensitivity. 著者: Lishko, P.V. / Procko, E. / Jin, X. / Phelps, C.B. / Gaudet, R. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  2pnn.cif.gz 2pnn.cif.gz | 59 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb2pnn.ent.gz pdb2pnn.ent.gz | 47.4 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  2pnn.json.gz 2pnn.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/pn/2pnn https://data.pdbj.org/pub/pdb/validation_reports/pn/2pnn ftp://data.pdbj.org/pub/pdb/validation_reports/pn/2pnn ftp://data.pdbj.org/pub/pdb/validation_reports/pn/2pnn | HTTPS FTP |
|---|
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| 単位格子 |
|
- 要素
要素
| #1: タンパク質 |  TRPV1 / TrpV1 / osm-9-like TRP channel 1 / OTRPC1 / Vanilloid receptor 1 / Vanilloid receptor type 1-like / ...TrpV1 / osm-9-like TRP channel 1 / OTRPC1 / Vanilloid receptor 1 / Vanilloid receptor type 1-like / Capsaicin receptor TRPV1 / TrpV1 / osm-9-like TRP channel 1 / OTRPC1 / Vanilloid receptor 1 / Vanilloid receptor type 1-like / ...TrpV1 / osm-9-like TRP channel 1 / OTRPC1 / Vanilloid receptor 1 / Vanilloid receptor type 1-like / Capsaicin receptor分子量: 30439.248 Da / 分子数: 1 / 断片: Ankyrin Repeat Domain / 由来タイプ: 組換発現 / 由来: (組換発現)   Rattus norvegicus (ドブネズミ) / 遺伝子: Trpv1, Vr1, Vr1l / プラスミド: PET21A / 生物種 (発現宿主): Escherichia coli / 発現宿主: Rattus norvegicus (ドブネズミ) / 遺伝子: Trpv1, Vr1, Vr1l / プラスミド: PET21A / 生物種 (発現宿主): Escherichia coli / 発現宿主:   Escherichia coli BL21(DE3) (大腸菌) / 株 (発現宿主): BL21 (DE3) / 参照: UniProt: O35433 Escherichia coli BL21(DE3) (大腸菌) / 株 (発現宿主): BL21 (DE3) / 参照: UniProt: O35433 |
|---|---|
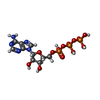
| #2: 化合物 | ChemComp-ATP /  アデノシン三リン酸 アデノシン三リン酸 |
| #3: 水 | ChemComp-HOH /  水 水 |
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 3.34 Å3/Da / 溶媒含有率: 63.14 % |
|---|---|
結晶化 | pH: 5 詳細: 3% PEG 8000, 0.1M SODIUM CITRATE, 5MM ATP, PH 5.0, VAPOR DIFFUSION, HANGING DROP, TEMPERATURE 277K, pH 5.00 |
-データ収集
| 回折 | 平均測定温度: 100 K |
|---|---|
| 放射光源 | 由来:  回転陽極 / タイプ: RIGAKU / 波長: 1.5418 / 波長: 1.5418 Å 回転陽極 / タイプ: RIGAKU / 波長: 1.5418 / 波長: 1.5418 Å |
| 検出器 | タイプ: RIGAKU RAXIS IV / 検出器: IMAGE PLATE / 日付: 2006年4月21日 / 詳細: mirrors |
| 放射 | モノクロメーター: Osmic mirrors / プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長 : 1.5418 Å / 相対比: 1 : 1.5418 Å / 相対比: 1 |
| 反射 | 解像度: 2.7→50 Å / Num. obs: 13575 / % possible obs: 100 % / Observed criterion σ(I): 1 / 冗長度: 4.5 % / Rmerge(I) obs: 0.107 / Net I/σ(I): 24.9 |
| 反射 シェル | 解像度: 2.7→2.8 Å / Mean I/σ(I) obs: 3.1 / Rsym value: 0.56 / % possible all: 99.7 |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法 : :  分子置換 / 解像度: 2.7→20 Å / Cor.coef. Fo:Fc: 0.948 / Cor.coef. Fo:Fc free: 0.92 / SU B: 26.929 / SU ML: 0.285 / TLS residual ADP flag: LIKELY RESIDUAL / 交差検証法: THROUGHOUT / σ(F): 0 / ESU R: 0.657 / ESU R Free: 0.32 / 立体化学のターゲット値: MAXIMUM LIKELIHOOD / 詳細: HYDROGENS HAVE BEEN ADDED IN THE RIDING POSITIONS 分子置換 / 解像度: 2.7→20 Å / Cor.coef. Fo:Fc: 0.948 / Cor.coef. Fo:Fc free: 0.92 / SU B: 26.929 / SU ML: 0.285 / TLS residual ADP flag: LIKELY RESIDUAL / 交差検証法: THROUGHOUT / σ(F): 0 / ESU R: 0.657 / ESU R Free: 0.32 / 立体化学のターゲット値: MAXIMUM LIKELIHOOD / 詳細: HYDROGENS HAVE BEEN ADDED IN THE RIDING POSITIONS
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | イオンプローブ半径: 0.8 Å / 減衰半径: 0.8 Å / VDWプローブ半径: 1.4 Å / 溶媒モデル: MASK | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 37.68 Å2
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 2.7→20 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | 解像度: 2.7→2.77 Å / Total num. of bins used: 20
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 TLS | 手法: refined / Refine-ID: X-RAY DIFFRACTION
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 TLSグループ |
|
 ムービー
ムービー コントローラー
コントローラー














 PDBj
PDBj