+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 1k4r | ||||||
|---|---|---|---|---|---|---|---|
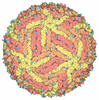
| タイトル | Structure of Dengue Virus | ||||||
 要素 要素 | MAJOR ENVELOPE PROTEIN E | ||||||
 キーワード キーワード |  VIRUS (ウイルス) / VIRUS (ウイルス) /  Flavivirus / Flavivirus /  Flaviviridae (フラビウイルス科) / Flaviviridae (フラビウイルス科) /  Dengue virus / glycoprotein E from tick-borne encephalitis virus / Icosahedral virus Dengue virus / glycoprotein E from tick-borne encephalitis virus / Icosahedral virus | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報 フラビビリン / symbiont-mediated suppression of host JAK-STAT cascade via inhibition of STAT2 activity / フラビビリン / symbiont-mediated suppression of host JAK-STAT cascade via inhibition of STAT2 activity /  double-stranded RNA binding / double-stranded RNA binding /  カプシド / nucleoside-triphosphate phosphatase / カプシド / nucleoside-triphosphate phosphatase /  mRNA (nucleoside-2'-O-)-methyltransferase activity / mRNA 5'-cap (guanine-N7-)-methyltransferase activity / membrane => GO:0016020 / mRNA (nucleoside-2'-O-)-methyltransferase activity / mRNA 5'-cap (guanine-N7-)-methyltransferase activity / membrane => GO:0016020 /  RNA helicase activity / host cell endoplasmic reticulum membrane ... RNA helicase activity / host cell endoplasmic reticulum membrane ... フラビビリン / symbiont-mediated suppression of host JAK-STAT cascade via inhibition of STAT2 activity / フラビビリン / symbiont-mediated suppression of host JAK-STAT cascade via inhibition of STAT2 activity /  double-stranded RNA binding / double-stranded RNA binding /  カプシド / nucleoside-triphosphate phosphatase / カプシド / nucleoside-triphosphate phosphatase /  mRNA (nucleoside-2'-O-)-methyltransferase activity / mRNA 5'-cap (guanine-N7-)-methyltransferase activity / membrane => GO:0016020 / mRNA (nucleoside-2'-O-)-methyltransferase activity / mRNA 5'-cap (guanine-N7-)-methyltransferase activity / membrane => GO:0016020 /  RNA helicase activity / host cell endoplasmic reticulum membrane / RNA helicase activity / host cell endoplasmic reticulum membrane /  protein dimerization activity / protein dimerization activity /  ヘリカーゼ / symbiont-mediated suppression of host type I interferon-mediated signaling pathway / induction by virus of host autophagy / viral RNA genome replication / ヘリカーゼ / symbiont-mediated suppression of host type I interferon-mediated signaling pathway / induction by virus of host autophagy / viral RNA genome replication /  RNA-dependent RNA polymerase activity / serine-type endopeptidase activity / fusion of virus membrane with host endosome membrane / host cell nucleus / endoplasmic reticulum membrane / virion attachment to host cell / virion membrane / structural molecule activity / extracellular region / RNA-dependent RNA polymerase activity / serine-type endopeptidase activity / fusion of virus membrane with host endosome membrane / host cell nucleus / endoplasmic reticulum membrane / virion attachment to host cell / virion membrane / structural molecule activity / extracellular region /  ATP binding / ATP binding /  metal ion binding / metal ion binding /  細胞核 細胞核類似検索 - 分子機能 | ||||||
| 生物種 |  Chimeric Tick-borne encephalitis virus/Dengue virus 4 (デング熱ウイルス) Chimeric Tick-borne encephalitis virus/Dengue virus 4 (デング熱ウイルス) | ||||||
| 手法 |  電子顕微鏡法 / 電子顕微鏡法 /  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 24 Å クライオ電子顕微鏡法 / 解像度: 24 Å | ||||||
 データ登録者 データ登録者 | Kuhn, R.J. / Zhang, W. / Rossmann, M.G. / Pletnev, S.V. / Corver, J. / Lenches, E. / Jones, C.T. / Mukhopadhyay, S. / Chipman, P.R. / Strauss, E.G. ...Kuhn, R.J. / Zhang, W. / Rossmann, M.G. / Pletnev, S.V. / Corver, J. / Lenches, E. / Jones, C.T. / Mukhopadhyay, S. / Chipman, P.R. / Strauss, E.G. / Baker, T.S. / Strauss, J.H. | ||||||
 引用 引用 |  ジャーナル: Cell / 年: 2002 ジャーナル: Cell / 年: 2002タイトル: Structure of dengue virus: implications for flavivirus organization, maturation, and fusion. 著者: Richard J Kuhn / Wei Zhang / Michael G Rossmann / Sergei V Pletnev / Jeroen Corver / Edith Lenches / Christopher T Jones / Suchetana Mukhopadhyay / Paul R Chipman / Ellen G Strauss / Timothy ...著者: Richard J Kuhn / Wei Zhang / Michael G Rossmann / Sergei V Pletnev / Jeroen Corver / Edith Lenches / Christopher T Jones / Suchetana Mukhopadhyay / Paul R Chipman / Ellen G Strauss / Timothy S Baker / James H Strauss /  要旨: The first structure of a flavivirus has been determined by using a combination of cryoelectron microscopy and fitting of the known structure of glycoprotein E into the electron density map. The virus ...The first structure of a flavivirus has been determined by using a combination of cryoelectron microscopy and fitting of the known structure of glycoprotein E into the electron density map. The virus core, within a lipid bilayer, has a less-ordered structure than the external, icosahedral scaffold of 90 glycoprotein E dimers. The three E monomers per icosahedral asymmetric unit do not have quasiequivalent symmetric environments. Difference maps indicate the location of the small membrane protein M relative to the overlaying scaffold of E dimers. The structure suggests that flaviviruses, and by analogy also alphaviruses, employ a fusion mechanism in which the distal beta barrels of domain II of the glycoprotein E are inserted into the cellular membrane. #1:  ジャーナル: Nature / 年: 1995 ジャーナル: Nature / 年: 1995タイトル: Virology. When It's Better to Lie Low 著者: Kuhn, R.J. / Rossmann, M.G. #2:  ジャーナル: Nature / 年: 1995 ジャーナル: Nature / 年: 1995タイトル: The Envelope Glycoprotein from Tick-borne Encephalitis Virus at 2 A Resolution 著者: Rey, F.A. / Heinz, F.X. / Mandl, C. / Kunz, C. / Harrison, S.C. | ||||||
| 履歴 |
| ||||||
| Remark 2 | RESOLUTION. 24.00 ANGSTROM. |
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  1k4r.cif.gz 1k4r.cif.gz | 225.1 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb1k4r.ent.gz pdb1k4r.ent.gz | 189 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  1k4r.json.gz 1k4r.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/k4/1k4r https://data.pdbj.org/pub/pdb/validation_reports/k4/1k4r ftp://data.pdbj.org/pub/pdb/validation_reports/k4/1k4r ftp://data.pdbj.org/pub/pdb/validation_reports/k4/1k4r | HTTPS FTP |
|---|
-関連構造データ
| 関連構造データ | |
|---|---|
| 類似構造データ |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 | x 60
|
| 2 |
|
| 3 | x 5
|
| 4 | x 6
|
| 5 | 
|
| 対称性 | 点対称性: (ヘルマン・モーガン記号 : 532 / シェーンフリース記号 : 532 / シェーンフリース記号 : I (正20面体型対称 : I (正20面体型対称 )) )) |
- 要素
要素
| #1: タンパク質 | 分子量: 43231.145 Da / 分子数: 3 / 断片: UNP residues 284-678 / 由来タイプ: 天然 由来: (天然)  Chimeric Tick-borne encephalitis virus/Dengue virus 4 (デング熱ウイルス) Chimeric Tick-borne encephalitis virus/Dengue virus 4 (デング熱ウイルス)属: Flavivirus  / 参照: UniProt: C3V005 / 参照: UniProt: C3V005 |
|---|
-実験情報
-実験
| 実験 | 手法:  電子顕微鏡法 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法:  単粒子再構成法 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: DENGUE VIRUS MAJOR ENVELOPE PROTEIN E / タイプ: VIRUS 詳細: SAMPLES WERE PREPARED AS THIN LAYERS OF VITREOUS ICE AND MAINTAINED AT NEAR LIQUID NITROGEN TEMPERATURE IN THE ELECTRON MICROSCOPE. |
|---|---|
| ウイルスについての詳細 | 中空か: NO / エンベロープを持つか: YES / ホストのカテゴリ: VERTEBRATES / 単離: SPECIES / タイプ: VIRION |
| 天然宿主 | 生物種: Primates |
| 緩衝液 | pH: 7.6 |
| 試料 | 包埋: NO / シャドウイング: NO / 染色 : NO / 凍結 : NO / 凍結 : YES : YES |
| 試料支持 | 詳細: sample conc. l2.0E10 PFU/ML |
急速凍結 | 詳細: LIQUID NITROGEN TEMPERATURE 50MM TRIS-HCL, 75MM NACL, 1MM EDTA |
結晶化 | *PLUS 手法:  cryo-electron microscopy cryo-electron microscopy |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 顕微鏡 | モデル: FEI/PHILIPS CM200T |
|---|---|
| 電子銃 | 電子線源 : :  FIELD EMISSION GUN / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD Bright-field microscopy / 倍率(公称値): 50000 X / 最大 デフォーカス(公称値): 1920 nm / 最小 デフォーカス(公称値): 790 nm / Cs Bright-field microscopy / 倍率(公称値): 50000 X / 最大 デフォーカス(公称値): 1920 nm / 最小 デフォーカス(公称値): 790 nm / Cs : 2 mm : 2 mm |
| 試料ホルダ | 温度: 100 K / 傾斜角・最大: 0 ° / 傾斜角・最小: 0 ° |
| 撮影 | 電子線照射量: 25.5 e/Å2 / フィルム・検出器のモデル: KODAK SO-163 FILM |
| 画像スキャン | デジタル画像の数: 25 |
| 反射 | 最高解像度: 24 Å |
- 解析
解析
| ソフトウェア |
| ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| EMソフトウェア |
| ||||||||||||
CTF補正 | 詳細: EACH VIRAL IMAGE WAS CTF CORRECTED BEFORE RECONSTRUCTION, BASED ON THE FOLLOWING EQUATION: F(CORR)=F(OBS)/[|CTF|+WIENER] | ||||||||||||
| 対称性 | 点対称性 : I (正20面体型対称 : I (正20面体型対称 ) ) | ||||||||||||
3次元再構成 | 手法: COMMON-LINES AND POLAR-FOURIER-TRANSFORM (FULLER ET AL. 1996, J.STRUC.BIOL. 116, 48-55 BAKER AND CHENG, 1996, J.STRUC.BIOL. 116, 120-130) SOFTWARE USED, PURDUE PROGRAMS 解像度: 24 Å / 粒子像の数: 526 / ピクセルサイズ(公称値): 2.8 Å / ピクセルサイズ(実測値): 2.9 Å / 対称性のタイプ: POINT | ||||||||||||
| 原子モデル構築 | プロトコル: RIGID BODY FIT / 空間: REAL 詳細: METHOD--IN THE FIRST STEP THE CRYSTAL STRUCTURE OF TBEV-E CRYSTALLOGRAPHIC DIMER (REY ET.AL., 1995 NATURELONDON) 375, 291-298) WAS ROTATED ABOUT AND TRANSLATEDAROUND AN ICOSAHEDRAL TWO FOLD ...詳細: METHOD--IN THE FIRST STEP THE CRYSTAL STRUCTURE OF TBEV-E CRYSTALLOGRAPHIC DIMER (REY ET.AL., 1995 NATURELONDON) 375, 291-298) WAS ROTATED ABOUT AND TRANSLATEDAROUND AN ICOSAHEDRAL TWO FOLD AXES TO FIND THE BEST FIT. AFTER THAT THE DENSITIES AT ALL PIXELS COVERED BY THE FIRST FITTED DIMER WERE SET TO ZERO. THE SECOND DIMER WAS THAN PLACED ON A RADIAL AXIS PASSING THROUGH A POINT NEAR THE QUASI-TWOFOLD AXIS. | ||||||||||||
| 原子モデル構築 | PDB-ID: 1SVB | ||||||||||||
| 精密化 | 最高解像度: 24 Å 詳細: Molecules of glycoprotein E of Tick-borne encephalitis virus were solved by using cryo-EM map of Dengue virus | ||||||||||||
| 精密化ステップ | サイクル: LAST / 最高解像度: 24 Å
|
 ムービー
ムービー コントローラー
コントローラー














 PDBj
PDBj