+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 1efc | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | INTACT ELONGATION FACTOR FROM E.COLI | ||||||
 要素 要素 | PROTEIN (ELONGATION FACTOR) | ||||||
 キーワード キーワード |  RNA BINDING PROTEIN (RNA結合タンパク質) / TRANSPORT AND PROTECTION PROTEIN RNA BINDING PROTEIN (RNA結合タンパク質) / TRANSPORT AND PROTECTION PROTEIN | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報guanyl-nucleotide exchange factor complex / translational elongation /  guanosine tetraphosphate binding / guanosine tetraphosphate binding /  translation elongation factor activity / response to antibiotic / translation elongation factor activity / response to antibiotic /  GTPase activity / GTP binding / GTPase activity / GTP binding /  RNA binding / RNA binding /  細胞膜 / 細胞膜 /  細胞質 細胞質類似検索 - 分子機能 | ||||||
| 生物種 |   Escherichia coli (大腸菌) Escherichia coli (大腸菌) | ||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  多波長異常分散 / 解像度: 2.05 Å 多波長異常分散 / 解像度: 2.05 Å | ||||||
 データ登録者 データ登録者 | Song, H. / Parsons, M.R. / Rowsell, S. / Leonard, G. / Phillips, S.E.V. | ||||||
 引用 引用 |  ジャーナル: J.Mol.Biol. / 年: 1999 ジャーナル: J.Mol.Biol. / 年: 1999タイトル: Crystal structure of intact elongation factor EF-Tu from Escherichia coli in GDP conformation at 2.05 A resolution. 著者: Song, H. / Parsons, M.R. / Rowsell, S. / Leonard, G. / Phillips, S.E. #1:  ジャーナル: Structure / 年: 1996 ジャーナル: Structure / 年: 1996タイトル: An Alpha to Beta Conformational Switch in EF-TU 著者: Abel, K. / Yoder, M.D. / Hilgenfeld, R. / Jurnak, F. #2:  ジャーナル: Structure / 年: 1996 ジャーナル: Structure / 年: 1996タイトル: Helix Unwinding in the Effector Region of Elongation Factor EF-TU-Gdp 著者: Polekhina, G. / Thirup, S. / Kjeldgaard, M. / Nissen, P. / Lippmann, C. / Nyborg, J. #3:  ジャーナル: Science / 年: 1995 ジャーナル: Science / 年: 1995タイトル: Crystal Structure of the Ternary Complex of Phe-tRNA, EF-TU and GTP Analogue 著者: Nissen, P. / Kjeldgaard, M. / Thirup, S. / Polekhina, G. / Reshetnikova, L. / Clark, B.F.C. / Nyborg, J. #4:  ジャーナル: Structure / 年: 1993 ジャーナル: Structure / 年: 1993タイトル: The Crystal Structure of Elongation Factor EF-TU from T. Aquaticus in the GTP Conformation 著者: Kjeldgaard, M. / Nissen, P. / Thirup, S. / Nyborg, J. #5:  ジャーナル: J.Mol.Biol. / 年: 1992 ジャーナル: J.Mol.Biol. / 年: 1992タイトル: Refined Structure of Elongation Factor EF-TU from E. Coli 著者: Kjeldgaard, M. / Nyborg, J. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  1efc.cif.gz 1efc.cif.gz | 170.2 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb1efc.ent.gz pdb1efc.ent.gz | 134.6 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  1efc.json.gz 1efc.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/ef/1efc https://data.pdbj.org/pub/pdb/validation_reports/ef/1efc ftp://data.pdbj.org/pub/pdb/validation_reports/ef/1efc ftp://data.pdbj.org/pub/pdb/validation_reports/ef/1efc | HTTPS FTP |
|---|
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||||
| 2 | 
| ||||||||||
| 単位格子 |
|
- 要素
要素
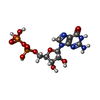
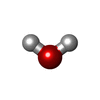
| #1: タンパク質 | 分子量: 43239.297 Da / 分子数: 2 / 由来タイプ: 組換発現 / 由来: (組換発現)   Escherichia coli (大腸菌) / 発現宿主: Escherichia coli (大腸菌) / 発現宿主:   Escherichia coli (大腸菌) / 参照: UniProt: P0A6N1, UniProt: P0CE47*PLUS Escherichia coli (大腸菌) / 参照: UniProt: P0A6N1, UniProt: P0CE47*PLUS#2: 化合物 | #3: 化合物 |  グアノシン二リン酸 グアノシン二リン酸#4: 水 | ChemComp-HOH / |  水 水配列の詳細 | EF-TU IS CODED FOR BY TWO DIFFERENT GENES. THE SEQUENCE STRUCTURE ANALYSIS CARRIED OUT ON THIS ...EF-TU IS CODED FOR BY TWO DIFFERENT GENES. THE SEQUENCE STRUCTURE ANALYSIS CARRIED OUT ON THIS MIXTURE SHOWS THAT THE C-TERMINAL RESIDUE OCCURS AS GLY/SER IN THE RATIO OF 3/ 1. THIS RESIDUE IS IDENTIFIED | |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 4 X線回折 / 使用した結晶の数: 4 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 3 Å3/Da / 溶媒含有率: 60 % | ||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
結晶化 | pH: 7.5 / 詳細: pH 7.5 | ||||||||||||||||||||||||||||||||||||||||||||||||
| 結晶化 | *PLUS pH: 8.5 / 手法: 蒸気拡散法, ハンギングドロップ法 | ||||||||||||||||||||||||||||||||||||||||||||||||
| 溶液の組成 | *PLUS
|
-データ収集
| 回折 | 平均測定温度: 100 K | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  ESRF ESRF  / ビームライン: BM14 / 波長: 0.97899,0.97916,0.91850 / ビームライン: BM14 / 波長: 0.97899,0.97916,0.91850 | ||||||||||||
| 検出器 | タイプ: MARRESEARCH / 検出器: IMAGE PLATE / 日付: 1996年10月15日 / 詳細: MIRRORS | ||||||||||||
| 放射 | プロトコル: MAD / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray | ||||||||||||
| 放射波長 |
| ||||||||||||
| 反射 | 解像度: 2.05→25 Å / Num. obs: 61876 / % possible obs: 90.5 % / 冗長度: 3.5 % / Biso Wilson estimate: 21.8 Å2 / Rmerge(I) obs: 0.082 / Rsym value: 0.082 | ||||||||||||
| 反射 シェル | 解像度: 2.05→2.1 Å / 冗長度: 3.5 % / Rmerge(I) obs: 0.274 / % possible all: 91.7 | ||||||||||||
| 反射 | *PLUS Num. measured all: 217915 | ||||||||||||
| 反射 シェル | *PLUS % possible obs: 91.7 % |
- 解析
解析
| ソフトウェア |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法 : :  多波長異常分散 / 解像度: 2.05→10 Å / 交差検証法: THROUGHOUT / ESU R: 0.18 多波長異常分散 / 解像度: 2.05→10 Å / 交差検証法: THROUGHOUT / ESU R: 0.18
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 24 Å2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 2.05→10 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー












 PDBj
PDBj