+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Focused refinement structure of Galpha(q) in NTSR1-GRK2-Galpha(q) complexes | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Biased signaling /  SIGNALING PROTEIN SIGNALING PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Fatty Acids bound to GPR40 (FFAR1) regulate insulin secretion / Acetylcholine regulates insulin secretion / PLC beta mediated events / phospholipase C-activating dopamine receptor signaling pathway /  regulation of platelet activation / entrainment of circadian clock / regulation of platelet activation / entrainment of circadian clock /  phototransduction, visible light / glutamate receptor signaling pathway / regulation of canonical Wnt signaling pathway / phototransduction, visible light / glutamate receptor signaling pathway / regulation of canonical Wnt signaling pathway /  活動電位 ...Fatty Acids bound to GPR40 (FFAR1) regulate insulin secretion / Acetylcholine regulates insulin secretion / PLC beta mediated events / phospholipase C-activating dopamine receptor signaling pathway / 活動電位 ...Fatty Acids bound to GPR40 (FFAR1) regulate insulin secretion / Acetylcholine regulates insulin secretion / PLC beta mediated events / phospholipase C-activating dopamine receptor signaling pathway /  regulation of platelet activation / entrainment of circadian clock / regulation of platelet activation / entrainment of circadian clock /  phototransduction, visible light / glutamate receptor signaling pathway / regulation of canonical Wnt signaling pathway / phototransduction, visible light / glutamate receptor signaling pathway / regulation of canonical Wnt signaling pathway /  活動電位 / 活動電位 /  : / photoreceptor outer segment / : / photoreceptor outer segment /  GTPase activator activity / G protein-coupled receptor binding / negative regulation of protein kinase activity / G-protein beta/gamma-subunit complex binding / Thromboxane signalling through TP receptor / G-protein activation / G protein-coupled acetylcholine receptor signaling pathway / adenylate cyclase-activating G protein-coupled receptor signaling pathway / ADP signalling through P2Y purinoceptor 1 / Cooperation of PDCL (PhLP1) and TRiC/CCT in G-protein beta folding / GTPase activator activity / G protein-coupled receptor binding / negative regulation of protein kinase activity / G-protein beta/gamma-subunit complex binding / Thromboxane signalling through TP receptor / G-protein activation / G protein-coupled acetylcholine receptor signaling pathway / adenylate cyclase-activating G protein-coupled receptor signaling pathway / ADP signalling through P2Y purinoceptor 1 / Cooperation of PDCL (PhLP1) and TRiC/CCT in G-protein beta folding /  heterotrimeric G-protein complex / heterotrimeric G-protein complex /  凝固・線溶系 / Thrombin signalling through proteinase activated receptors (PARs) / G alpha (q) signalling events / 凝固・線溶系 / Thrombin signalling through proteinase activated receptors (PARs) / G alpha (q) signalling events /  核膜 / protein stabilization / lysosomal membrane / 核膜 / protein stabilization / lysosomal membrane /  GTPase activity / GTPase activity /  シナプス / GTP binding / シナプス / GTP binding /  ゴルジ体 / extracellular exosome / ゴルジ体 / extracellular exosome /  metal ion binding / metal ion binding /  細胞膜 / 細胞膜 /  細胞質 細胞質類似検索 - 分子機能 | |||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 2.91 Å クライオ電子顕微鏡法 / 解像度: 2.91 Å | |||||||||
 データ登録者 データ登録者 | Duan J / Liu H / Zhao F / Yuan Q / Ji Y / Xu HE | |||||||||
| 資金援助 |  中国, 1件 中国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nature / 年: 2023 ジャーナル: Nature / 年: 2023タイトル: GPCR activation and GRK2 assembly by a biased intracellular agonist. 著者: Jia Duan / Heng Liu / Fenghui Zhao / Qingning Yuan / Yujie Ji / Xiaoqing Cai / Xinheng He / Xinzhu Li / Junrui Li / Kai Wu / Tianyu Gao / Shengnan Zhu / Shi Lin / Ming-Wei Wang / Xi Cheng / ...著者: Jia Duan / Heng Liu / Fenghui Zhao / Qingning Yuan / Yujie Ji / Xiaoqing Cai / Xinheng He / Xinzhu Li / Junrui Li / Kai Wu / Tianyu Gao / Shengnan Zhu / Shi Lin / Ming-Wei Wang / Xi Cheng / Wanchao Yin / Yi Jiang / Dehua Yang / H Eric Xu /  要旨: Phosphorylation of G-protein-coupled receptors (GPCRs) by GPCR kinases (GRKs) desensitizes G-protein signalling and promotes arrestin signalling, which is also modulated by biased ligands. The ...Phosphorylation of G-protein-coupled receptors (GPCRs) by GPCR kinases (GRKs) desensitizes G-protein signalling and promotes arrestin signalling, which is also modulated by biased ligands. The molecular assembly of GRKs on GPCRs and the basis of GRK-mediated biased signalling remain largely unknown owing to the weak GPCR-GRK interactions. Here we report the complex structure of neurotensin receptor 1 (NTSR1) bound to GRK2, Gα and the arrestin-biased ligand SBI-553. The density map reveals the arrangement of the intact GRK2 with the receptor, with the N-terminal helix of GRK2 docking into the open cytoplasmic pocket formed by the outward movement of the receptor transmembrane helix 6, analogous to the binding of the G protein to the receptor. SBI-553 binds at the interface between GRK2 and NTSR1 to enhance GRK2 binding. The binding mode of SBI-553 is compatible with arrestin binding but clashes with the binding of Gα protein, thus providing a mechanism for its arrestin-biased signalling capability. In sum, our structure provides a rational model for understanding the details of GPCR-GRK interactions and GRK2-mediated biased signalling. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_36477.map.gz emd_36477.map.gz | 117.7 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-36477-v30.xml emd-36477-v30.xml emd-36477.xml emd-36477.xml | 15.1 KB 15.1 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_36477.png emd_36477.png | 18.4 KB | ||
| マスクデータ |  emd_36477_msk_1.map emd_36477_msk_1.map | 125 MB |  マスクマップ マスクマップ | |
| その他 |  emd_36477_half_map_1.map.gz emd_36477_half_map_1.map.gz emd_36477_half_map_2.map.gz emd_36477_half_map_2.map.gz | 116 MB 116 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-36477 http://ftp.pdbj.org/pub/emdb/structures/EMD-36477 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-36477 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-36477 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_36477.map.gz / 形式: CCP4 / 大きさ: 125 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_36477.map.gz / 形式: CCP4 / 大きさ: 125 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ボクセルのサイズ | X=Y=Z: 0.824 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_36477_msk_1.map emd_36477_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_36477_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_36477_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Focused refinement structure of Galpha(q) in NTSR1-GRK2-Galpha(q)...
| 全体 | 名称: Focused refinement structure of Galpha(q) in NTSR1-GRK2-Galpha(q) complexes |
|---|---|
| 要素 |
|
-超分子 #1: Focused refinement structure of Galpha(q) in NTSR1-GRK2-Galpha(q)...
| 超分子 | 名称: Focused refinement structure of Galpha(q) in NTSR1-GRK2-Galpha(q) complexes タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Guanine nucleotide-binding protein G(q) subunit alpha
| 分子 | 名称: Guanine nucleotide-binding protein G(q) subunit alpha タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 41.282895 KDa |
| 組換発現 | 生物種:   Spodoptera frugiperda (ツマジロクサヨトウ) Spodoptera frugiperda (ツマジロクサヨトウ) |
| 配列 | 文字列: MGCTLSAEDK AAVERSKMID RNLREDGERS RRELKLLLLG TGESGKSTFI KQMRIIHGSG YSDEDKRGFT KLVYQNIFTA MQAMIRAMD TLKIPYKYEH NKAHAQLVRE VDVEKVSAFE NPYVDAIKSL WNDPGIQECY DRRREYQLSD STKYYLNDLD R VADPAYLP ...文字列: MGCTLSAEDK AAVERSKMID RNLREDGERS RRELKLLLLG TGESGKSTFI KQMRIIHGSG YSDEDKRGFT KLVYQNIFTA MQAMIRAMD TLKIPYKYEH NKAHAQLVRE VDVEKVSAFE NPYVDAIKSL WNDPGIQECY DRRREYQLSD STKYYLNDLD R VADPAYLP TQQDVLRVRV PTTGIIEYPF DLQSVIFRMV DVGGQRSERR KWIHCFENVT SIMFLVALSE YDQVLVESDN EN RMEESKA LFRTIITYPW FQNSSVILFL NKKDLLEEKI MYSHLVDYFP EYDGPQRDAQ AAREFILKMF VDLNPDSDKI IYS HFTCAT DTENIRFVFA AVKDTILQLN LKEYNLV UniProtKB: Guanine nucleotide-binding protein G(q) subunit alpha |
-分子 #2: GUANOSINE-5'-DIPHOSPHATE
| 分子 | 名称: GUANOSINE-5'-DIPHOSPHATE / タイプ: ligand / ID: 2 / コピー数: 1 / 式: GDP |
|---|---|
| 分子量 | 理論値: 443.201 Da |
| Chemical component information | 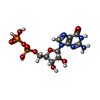 ChemComp-GDP: |
-分子 #3: MAGNESIUM ION
| 分子 | 名称: MAGNESIUM ION / タイプ: ligand / ID: 3 / コピー数: 1 / 式: MG |
|---|---|
| 分子量 | 理論値: 24.305 Da |
-分子 #4: TETRAFLUOROALUMINATE ION
| 分子 | 名称: TETRAFLUOROALUMINATE ION / タイプ: ligand / ID: 4 / コピー数: 1 / 式: ALF |
|---|---|
| 分子量 | 理論値: 102.975 Da |
| Chemical component information | 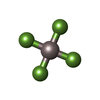 ChemComp-ALF: |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.4 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: DARK FIELD / 最大 デフォーカス(公称値): 2.2 µm / 最小 デフォーカス(公称値): 1.2 µm |
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 平均電子線量: 50.0 e/Å2 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 初期モデル | モデルのタイプ: NONE |
|---|---|
| 初期 角度割当 | タイプ: RANDOM ASSIGNMENT |
| 最終 角度割当 | タイプ: MAXIMUM LIKELIHOOD |
| 最終 再構成 | 解像度のタイプ: BY AUTHOR / 解像度: 2.91 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 使用した粒子像数: 474232 |
 ムービー
ムービー コントローラー
コントローラー





















 Z
Z Y
Y X
X

























