+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Engineered human dynein motor domain in the microtubule-unbound state with LIS1 complex in the buffer containing ATP-Vi (local refined on AAA3-AAA5 and LIS1) | ||||||||||||
 マップデータ マップデータ | Unsharpened map of engineered human dynein motor domain in microtubule-unbound state with LIS1 complex in buffer containing ATP-Vi (local refined on AAA3-AAA5 and LIS1 region) | ||||||||||||
 試料 試料 |
| ||||||||||||
 キーワード キーワード |  Dynein (ダイニン) / Dynein (ダイニン) /  motor domain (機関 (機械)) / microtubule-unbound / motor domain (機関 (機械)) / microtubule-unbound /  MOTOR PROTEIN (モータータンパク質) / MOTOR PROTEIN (モータータンパク質) /  LIS1 LIS1 | ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報corpus callosum morphogenesis / establishment of planar polarity of embryonic epithelium / microtubule cytoskeleton organization involved in establishment of planar polarity / ameboidal-type cell migration / interneuron migration /  1-alkyl-2-acetylglycerophosphocholine esterase complex / maintenance of centrosome location / microtubule sliding / selenocysteine biosynthetic process / platelet activating factor metabolic process ...corpus callosum morphogenesis / establishment of planar polarity of embryonic epithelium / microtubule cytoskeleton organization involved in establishment of planar polarity / ameboidal-type cell migration / interneuron migration / 1-alkyl-2-acetylglycerophosphocholine esterase complex / maintenance of centrosome location / microtubule sliding / selenocysteine biosynthetic process / platelet activating factor metabolic process ...corpus callosum morphogenesis / establishment of planar polarity of embryonic epithelium / microtubule cytoskeleton organization involved in establishment of planar polarity / ameboidal-type cell migration / interneuron migration /  1-alkyl-2-acetylglycerophosphocholine esterase complex / maintenance of centrosome location / microtubule sliding / selenocysteine biosynthetic process / platelet activating factor metabolic process / radial glia-guided pyramidal neuron migration / microtubule organizing center organization / 1-alkyl-2-acetylglycerophosphocholine esterase complex / maintenance of centrosome location / microtubule sliding / selenocysteine biosynthetic process / platelet activating factor metabolic process / radial glia-guided pyramidal neuron migration / microtubule organizing center organization /  セリンtRNAリガーゼ / セリンtRNAリガーゼ /  serine-tRNA ligase activity / seryl-tRNA aminoacylation / cerebral cortex neuron differentiation / positive regulation of intracellular transport / central region of growth cone / serine-tRNA ligase activity / seryl-tRNA aminoacylation / cerebral cortex neuron differentiation / positive regulation of intracellular transport / central region of growth cone /  acrosome assembly / positive regulation of embryonic development / reelin-mediated signaling pathway / regulation of metaphase plate congression / establishment of centrosome localization / positive regulation of cytokine-mediated signaling pathway / cortical microtubule organization / establishment of spindle localization / astral microtubule / positive regulation of spindle assembly / layer formation in cerebral cortex / nuclear membrane disassembly / auditory receptor cell development / positive regulation of dendritic spine morphogenesis / vesicle transport along microtubule / stem cell division / stereocilium / myeloid leukocyte migration / acrosome assembly / positive regulation of embryonic development / reelin-mediated signaling pathway / regulation of metaphase plate congression / establishment of centrosome localization / positive regulation of cytokine-mediated signaling pathway / cortical microtubule organization / establishment of spindle localization / astral microtubule / positive regulation of spindle assembly / layer formation in cerebral cortex / nuclear membrane disassembly / auditory receptor cell development / positive regulation of dendritic spine morphogenesis / vesicle transport along microtubule / stem cell division / stereocilium / myeloid leukocyte migration /  dynein complex / dynein complex /  P-body assembly / COPI-independent Golgi-to-ER retrograde traffic / negative regulation of JNK cascade / microtubule plus-end binding / minus-end-directed microtubule motor activity / retrograde axonal transport / P-body assembly / COPI-independent Golgi-to-ER retrograde traffic / negative regulation of JNK cascade / microtubule plus-end binding / minus-end-directed microtubule motor activity / retrograde axonal transport /  cytoplasmic dynein complex / dynein light intermediate chain binding / brain morphogenesis / cytoplasmic dynein complex / dynein light intermediate chain binding / brain morphogenesis /  繊毛 / nuclear migration / osteoclast development / microtubule associated complex / 繊毛 / nuclear migration / osteoclast development / microtubule associated complex /  kinesin complex / dynein intermediate chain binding / dynein complex binding / cochlea development / transmission of nerve impulse / cytoplasmic microtubule / cell leading edge / germ cell development / establishment of mitotic spindle orientation / kinesin complex / dynein intermediate chain binding / dynein complex binding / cochlea development / transmission of nerve impulse / cytoplasmic microtubule / cell leading edge / germ cell development / establishment of mitotic spindle orientation /  dynactin binding / dynactin binding /  phospholipase binding / neuromuscular process controlling balance / neuroblast proliferation / phospholipase binding / neuromuscular process controlling balance / neuroblast proliferation /  protein secretion / positive regulation of axon extension / Amplification of signal from unattached kinetochores via a MAD2 inhibitory signal / microtubule-based process / COPI-mediated anterograde transport / regulation of microtubule cytoskeleton organization / protein secretion / positive regulation of axon extension / Amplification of signal from unattached kinetochores via a MAD2 inhibitory signal / microtubule-based process / COPI-mediated anterograde transport / regulation of microtubule cytoskeleton organization /  stress granule assembly / lipid catabolic process / cytoplasmic microtubule organization / Mitotic Prometaphase / EML4 and NUDC in mitotic spindle formation / axon cytoplasm / regulation of mitotic spindle organization / JNK cascade / Loss of Nlp from mitotic centrosomes / Loss of proteins required for interphase microtubule organization from the centrosome / Recruitment of mitotic centrosome proteins and complexes / Resolution of Sister Chromatid Cohesion / Recruitment of NuMA to mitotic centrosomes / HSP90 chaperone cycle for steroid hormone receptors (SHR) in the presence of ligand / Anchoring of the basal body to the plasma membrane / MHC class II antigen presentation / positive regulation of mitotic cell cycle / AURKA Activation by TPX2 / adult locomotory behavior / mitotic spindle organization / stress granule assembly / lipid catabolic process / cytoplasmic microtubule organization / Mitotic Prometaphase / EML4 and NUDC in mitotic spindle formation / axon cytoplasm / regulation of mitotic spindle organization / JNK cascade / Loss of Nlp from mitotic centrosomes / Loss of proteins required for interphase microtubule organization from the centrosome / Recruitment of mitotic centrosome proteins and complexes / Resolution of Sister Chromatid Cohesion / Recruitment of NuMA to mitotic centrosomes / HSP90 chaperone cycle for steroid hormone receptors (SHR) in the presence of ligand / Anchoring of the basal body to the plasma membrane / MHC class II antigen presentation / positive regulation of mitotic cell cycle / AURKA Activation by TPX2 / adult locomotory behavior / mitotic spindle organization /  filopodium / RHO GTPases Activate Formins / hippocampus development / filopodium / RHO GTPases Activate Formins / hippocampus development /  phosphoprotein binding / phosphoprotein binding /  neuron migration / Schaffer collateral - CA1 synapse / modulation of chemical synaptic transmission / cerebral cortex development / neuron migration / Schaffer collateral - CA1 synapse / modulation of chemical synaptic transmission / cerebral cortex development /  動原体 / microtubule cytoskeleton organization / Aggrephagy 動原体 / microtubule cytoskeleton organization / Aggrephagy類似検索 - 分子機能 | ||||||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||||||||
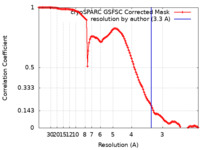
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.3 Å クライオ電子顕微鏡法 / 解像度: 3.3 Å | ||||||||||||
 データ登録者 データ登録者 | Ton W / Wang Y / Chai P | ||||||||||||
| 資金援助 |  米国, 3件 米国, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: Nat Struct Mol Biol / 年: 2023 ジャーナル: Nat Struct Mol Biol / 年: 2023タイトル: Microtubule-binding-induced allostery triggers LIS1 dissociation from dynein prior to cargo transport. 著者: William D Ton / Yue Wang / Pengxin Chai / Cisloynny Beauchamp-Perez / Nicholas T Flint / Lindsay G Lammers / Hao Xiong / Kai Zhang / Steven M Markus /  要旨: The lissencephaly-related protein LIS1 is a critical regulator of cytoplasmic dynein that governs motor function and intracellular localization (for example, to microtubule plus-ends). Although LIS1 ...The lissencephaly-related protein LIS1 is a critical regulator of cytoplasmic dynein that governs motor function and intracellular localization (for example, to microtubule plus-ends). Although LIS1 binding is required for dynein activity, its unbinding prior to initiation of cargo transport is equally important, since preventing dissociation leads to dynein dysfunction. To understand whether and how dynein-LIS1 binding is modulated, we engineered dynein mutants locked in a microtubule-bound (MT-B) or microtubule-unbound (MT-U) state. Whereas the MT-B mutant exhibits low LIS1 affinity, the MT-U mutant binds LIS1 with high affinity, and as a consequence remains almost irreversibly associated with microtubule plus-ends. We find that a monomeric motor domain is sufficient to exhibit these opposing LIS1 affinities, and that this is evolutionarily conserved between yeast and humans. Three cryo-EM structures of human dynein with and without LIS1 reveal microtubule-binding induced conformational changes responsible for this regulation. Our work reveals key biochemical and structural insight into LIS1-mediated dynein activation. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_29014.map.gz emd_29014.map.gz | 89.9 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-29014-v30.xml emd-29014-v30.xml emd-29014.xml emd-29014.xml | 23.7 KB 23.7 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_29014_fsc.xml emd_29014_fsc.xml | 11.8 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_29014.png emd_29014.png | 73.4 KB | ||
| マスクデータ |  emd_29014_msk_1.map emd_29014_msk_1.map | 178 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-29014.cif.gz emd-29014.cif.gz | 8.8 KB | ||
| その他 |  emd_29014_half_map_1.map.gz emd_29014_half_map_1.map.gz emd_29014_half_map_2.map.gz emd_29014_half_map_2.map.gz | 165 MB 165 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-29014 http://ftp.pdbj.org/pub/emdb/structures/EMD-29014 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-29014 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-29014 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_29014.map.gz / 形式: CCP4 / 大きさ: 178 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_29014.map.gz / 形式: CCP4 / 大きさ: 178 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Unsharpened map of engineered human dynein motor domain in microtubule-unbound state with LIS1 complex in buffer containing ATP-Vi (local refined on AAA3-AAA5 and LIS1 region) | ||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.149 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_29014_msk_1.map emd_29014_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Half map A of engineered human dynein motor...
| ファイル | emd_29014_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map A of engineered human dynein motor domain in microtubule-unbound state with LIS1 complex in buffer containing ATP-Vi (local refined on AAA3-AAA5 and LIS1 region) | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Half map B of engineered human dynein motor...
| ファイル | emd_29014_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map B of engineered human dynein motor domain in microtubule-unbound state with LIS1 complex in buffer containing ATP-Vi (local refined on AAA3-AAA5 and LIS1 region) | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Engineered human dynein motor domain in microtubule-unbound state...
| 全体 | 名称: Engineered human dynein motor domain in microtubule-unbound state with LIS1 complex in the buffer containing ATP-Vi |
|---|---|
| 要素 |
|
-超分子 #1: Engineered human dynein motor domain in microtubule-unbound state...
| 超分子 | 名称: Engineered human dynein motor domain in microtubule-unbound state with LIS1 complex in the buffer containing ATP-Vi タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#2 |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 490 KDa |
-分子 #1: Cytoplasmic dynein 1 heavy chain 1,Serine--tRNA ligase
| 分子 | 名称: Cytoplasmic dynein 1 heavy chain 1,Serine--tRNA ligase タイプ: protein_or_peptide / ID: 1 詳細: residues 1458-3277 of dynein followed by residues 30-96 of serine-tRNA ligase, followed by residues 3412-4646 of dynein コピー数: 1 / 光学異性体: LEVO / EC番号:  セリンtRNAリガーゼ セリンtRNAリガーゼ |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 357.459125 KDa |
| 組換発現 | 生物種:   Spodoptera frugiperda (ツマジロクサヨトウ) Spodoptera frugiperda (ツマジロクサヨトウ) |
| 配列 | 文字列: GSALEEFLKQ IREVWNTYEL DLVNYQNKCR LIRGWDDLFN KVKEHINSVS AMKLSPYYKV FEEDALSWED KLNRIMALFD VWIDVQRRW VYLEGIFTGS ADIKHLLPVE TQRFQSISTE FLALMKKVSK SPLVMDVLNI QGVQRSLERL ADLLGKIQKA L GEYLERER ...文字列: GSALEEFLKQ IREVWNTYEL DLVNYQNKCR LIRGWDDLFN KVKEHINSVS AMKLSPYYKV FEEDALSWED KLNRIMALFD VWIDVQRRW VYLEGIFTGS ADIKHLLPVE TQRFQSISTE FLALMKKVSK SPLVMDVLNI QGVQRSLERL ADLLGKIQKA L GEYLERER SSFPRFYFVG DEDLLEIIGN SKNVAKLQKH FKKMFAGVSS IILNEDNSVV LGISSREGEE VMFKTPVSIT EH PKINEWL TLVEKEMRVT LAKLLAESVT EVEIFGKATS IDPNTYITWI DKYQAQLVVL SAQIAWSENV ETALSSMGGG GDA APLHSV LSNVEVTLNV LADSVLMEQP PLRRRKLEHL ITELVHQRDV TRSLIKSKID NAKSFEWLSQ MRFYFDPKQT DVLQ QLSIQ MANAKFNYGF EYLGVQDKLV QTPLTDRCYL TMTQALEARL GGSPFGPAGT GKTESVKALG HQLGRFVLVF NCDET FDFQ AMGRIFVGLC QVGAWGCFDE FNRLEERMLS AVSQQVQCIQ EALREHSNPN YDKTSAPITC ELLNKQVKVS PDMAIF ITM NPGYAGRSNL PDNLKKLFRS LAMTKPDRQL IAQVMLYSQG FRTAEVLANK IVPFFKLCDE QLSSQSHYDF GLRALKS VL VSAGNVKRER IQKIKREKEE RGEAVDEGEI AENLPEQEIL IQSVCETMVP KLVAEDIPLL FSLLSDVFPG VQYHRGEM T ALREELKKVC QEMYLTYGDG EEVGGMWVEK VLQLYQITQI NHGLMMVGPS GSGKSMAWRV LLKALERLEG VEGVAHIID PKAISKDHLY GTLDPNTREW TDGLFTHVLR KIIDSVRGEL QKRQWIVFDG DVDPEWVENL NSVLDDNKLL TLPNGERLSL PPNVRIMFE VQDLKYATLA TVSRCGMVWF SEDVLSTDMI FNNFLARLRS IPLDEGEDEA QRRRKGKEDE GEEAASPMLQ I QRDAATIM QPYFTSNGLV TKALEHAFQL EHIMDLTRLR CLGSLFSMLH QACRNVAQYN ANHPDFPMQI EQLERYIQRY LV YAILWSL SGDSRLKMRA ELGEYIRRIT TVPLPTAPNI PIIDYEVSIS GEWSPWQAKV PQIEVETHKV AAPDVVVPTL DTV RHEALL YTWLAEHKPL VLCGPPGSGK TMTLFSALRA LPDMEVVGLN FSSATTPELL LKTFDHYCEY RRTPNGVVLA PVQL GKWLV LFCDEINLPD MDKYGTQRVI SFIRQMVEHG GFYRTSDQTW VKLERIQFVG ACNPPTDPGR KPLSHRFLRH VPVVY VDYP GPASLTQIYG TFNRAMLRLI PSLRTYAEPL TAAMVEFYTM SQERFTQDTQ PHYIYSPREM TRWVRGIFEA LRPLET LPV EGLIRIWAHE ALRLFQDRLV EDEERRWTDE NIDTVALKHF PNIDREKAMS RPILYSNWLS KDYIPVDQEE LRDYVKA RL KVFYEEELDV PLVLFNEVLD HVLRIDRIFR QPQGHLLLIG VSGAGKTTLS RFVAWMNGLS VYQIKVHRKY TGEDFDED L RTVLRRSGCK NEKIAFIMDE SNVLDSGFLE RMNTLLANGE VPGLFEGDEY ATLMTQCKEG AQKEGLMLDS HEELYKWFT SQVIRNLHVV FTMNPSSEGL KDRAATSPAL FNRCVLNWFG DWSTEALYQV GKEFTSKMDL EKPNYIVPDY MPVVYDKLPQ PPSHREAIV NSCVFVHQTL HQANARLAKR GGRTMAITPR HYLDFINHYA NLFHEKRSEL EEQQMHLNVG LRKIKETVDQ V EELRRDLR IKSQELEVKN AAANDKLKKM VKDQQEAEKK KVMSQEIQEQ LHKQQEVIAD KQMSLLALDQ EVQELKKRLQ EV QTERNQV AKRVPKAPPE EKEALIARGR ALGEEAKRLE EALREKEAQL EALRNELQKL EDDAKDNQQK ANEVEQMIRD LEA SIARYK EEYAVLISEA QAIKADLAAV EAKVNRSTAL LKSLSAERER WEKTSETFKN QMSTIAGDCL LSAAFIAYAG YFDQ QMRQN LFTTWSHHLQ QANIQFRTDI ARTEYLSNAD ERLRWQASSL PADDLCTENA IMLKRFNRYP LIIDPSGQAT EFIMN EYKD RKITRTSFLD DAFRKNLESA LRFGNPLLVQ DVESYDPVLN PVLNREVRRT GGRVLITLGD QDIDLSPSFV IFLSTR DPT VEFPPDLCSR VTFVNFTVTR SSLQSQCLNE VLKAERPDVD EKRSDLLKLQ GEFQLRLRQL EKSLLQALNE VKGRILD DD TIITTLENLK REAAEVTRKV EETDIVMQEV ETVSQQYLPL STACSSIYFT MESLKQIHFL YQYSLQFFLD IYHNVLYE N PNLKGVTDHT QRLSIITKDL FQVAFNRVAR GMLHQDHITF AMLLARIKLK GTVGEPTYDA EFQHFLRGNE IVLSAGSTP RIQGLTVEQA EAVVRLSCLP AFKDLIAKVQ ADEQFGIWLD SSSPEQTVPY LWSEETPATP IGQAIHRLLL IQAFRPDRLL AMAHMFVST NLGESFMSIM EQPLDLTHIV GTEVKPNTPV LMCSVPGYDA SGHVEDLAAE QNTQITSIAI GSAEGFNQAD K AINTAVKS GRWVMLKNVH LAPGWLMQLE KKLHSLQPHA CFRLFLTMEI NPKVPVNLLR AGRIFVFEPP PGVKANMLRT FS SIPVSRI CKSPNERARL YFLLAWFHAI IQERLRYAPL GWSKKYEFGE SDLRSACDTV DTWLDDTAKG RQNISPDKIP WSA LKTLMA QSIYGGRVDN EFDQRLLNTF LERLFTTRSF DSEFKLACKV DGHKDIQMPD GIRREEFVQW VELLPDTQTP SWLG LPNNA ERVLLTTQGV DMISKMLKMQ MLEDEDDLAY AETEKKTRTD STSDGRPAWM RTLHTTASNW LHLIPQTLSH LKRTV ENIK DPLFRFFERE VKMGAKLLQD VRQDLADVVQ VCEGKKKQTN YLRTLINELV KGILPRSWSH YTVPAGMTVI QWVSDF SER IKQLQNISLA AASGGAKELK NIHVCLGGLF VPEAYITATR QYVAQANSWS LEELCLEVNV TTSQGATLDA CSFGVTG LK LQGATCNNNK LSLSNAISTA LPLTQLRWVK QTNTEKKASV VTLPVYLNFT RADLIFTVDF EIATKEDPRS FYERGVAV L CTEEF UniProtKB: Cytoplasmic dynein 1 heavy chain 1, Serine--tRNA ligase, Cytoplasmic dynein 1 heavy chain 1 |
-分子 #2: Platelet-activating factor acetylhydrolase IB subunit beta,Platel...
| 分子 | 名称: Platelet-activating factor acetylhydrolase IB subunit beta,Platelet-activating factor acetylhydrolase IB subunit beta,human LIS1 protein with a SNAP tag タイプ: protein_or_peptide / ID: 2 詳細: SNAP tag present on C-terminus,SNAP tag present on C-terminus コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 66.423547 KDa |
| 組換発現 | 生物種:   Spodoptera frugiperda (ツマジロクサヨトウ) Spodoptera frugiperda (ツマジロクサヨトウ) |
| 配列 | 文字列: GSVLSQRQRD ELNRAIADYL RSNGYEEAYS VFKKEAELDV NEELDKKYAG LLEKKWTSVI RLQKKVMELE SKLNEAKEEF TSGGPLGQK RDPKEWIPRP PEKYALSGHR SPVTRVIFHP VFSVMVSASE DATIKVWDYE TGDFERTLKG HTDSVQDISF D HSGKLLAS ...文字列: GSVLSQRQRD ELNRAIADYL RSNGYEEAYS VFKKEAELDV NEELDKKYAG LLEKKWTSVI RLQKKVMELE SKLNEAKEEF TSGGPLGQK RDPKEWIPRP PEKYALSGHR SPVTRVIFHP VFSVMVSASE DATIKVWDYE TGDFERTLKG HTDSVQDISF D HSGKLLAS CSADMTIKLW DFQGFECIRT MHGHDHNVSS VAIMPNGDHI VSASRDKTIK MWEVQTGYCV KTFTGHREWV RM VRPNQDG TLIASCSNDQ TVRVWVVATK ECKAELREHE HVVECISWAP ESSYSSISEA TGSETKKSGK PGPFLLSGSR DKT IKMWDV STGMCLMTLV GHDNWVRGVL FHSGGKFILS CADDKTLRVW DYKNKRCMKT LNAHEHFVTS LDFHKTAPYV VTGS VDQTV KVWECRGAGA GADKDCEMKR TTLDSPLGKL ELSGCEQGLH RIIFLGKGTS AADAVEVPAP AAVLGGPEPL MQATA WLNA YFHQPEAIEE FPVPALHHPV FQQESFTRQV LWKLLKVVKF GEVISYSHLA ALAGNPAATA AVKTALSGNP VPILIP CHR VVQGDLDVGG YEGGLAVKEW LLAHEGHRLG KPGLG UniProtKB: Platelet-activating factor acetylhydrolase IB subunit beta |
-分子 #3: ADENOSINE-5'-DIPHOSPHATE
| 分子 | 名称: ADENOSINE-5'-DIPHOSPHATE / タイプ: ligand / ID: 3 / コピー数: 2 / 式: ADP |
|---|---|
| 分子量 | 理論値: 427.201 Da |
| Chemical component information |  ChemComp-ADP: |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.5 mg/mL |
|---|---|
| 緩衝液 | pH: 7.4 詳細: 50 mM Tris pH 7.4, 150 mM potassium acetate, 2 mM magnesium acetate, 1 mM EGTA, 1 mM DTT, and 0.1 mM Mg-ATP |
| グリッド | モデル: Quantifoil R2/1 / 材質: COPPER / メッシュ: 300 / 支持フィルム - 材質: GRAPHENE OXIDE / 支持フィルム - トポロジー: CONTINUOUS / 支持フィルム - Film thickness: 1 / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 60 sec. / 前処理 - 雰囲気: AIR |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 95 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 100.0 µm / 最大 デフォーカス(補正後): 3.0 µm / 最小 デフォーカス(補正後): 1.2 µm / 倍率(補正後): 105000 / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / Cs: 2.7 mm / 最大 デフォーカス(公称値): 3.0 µm / 最小 デフォーカス(公称値): 1.2 µm / 倍率(公称値): 105000 Bright-field microscopy / Cs: 2.7 mm / 最大 デフォーカス(公称値): 3.0 µm / 最小 デフォーカス(公称値): 1.2 µm / 倍率(公称値): 105000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 検出モード: SUPER-RESOLUTION / 平均電子線量: 40.0 e/Å2 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
-原子モデル構築 1
| 精密化 | 空間: REAL / プロトコル: RIGID BODY FIT |
|---|---|
| 得られたモデル |  PDB-8fdu: |
 ムービー
ムービー コントローラー
コントローラー






























 Z
Z Y
Y X
X