+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Structure of human cytoplasmic dynein-1 bound to one Lis1 | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報corpus callosum morphogenesis / establishment of planar polarity of embryonic epithelium / microtubule cytoskeleton organization involved in establishment of planar polarity / ameboidal-type cell migration / interneuron migration /  1-alkyl-2-acetylglycerophosphocholine esterase complex / maintenance of centrosome location / microtubule sliding / platelet activating factor metabolic process / 1-alkyl-2-acetylglycerophosphocholine esterase complex / maintenance of centrosome location / microtubule sliding / platelet activating factor metabolic process /  acrosome assembly ...corpus callosum morphogenesis / establishment of planar polarity of embryonic epithelium / microtubule cytoskeleton organization involved in establishment of planar polarity / ameboidal-type cell migration / interneuron migration / acrosome assembly ...corpus callosum morphogenesis / establishment of planar polarity of embryonic epithelium / microtubule cytoskeleton organization involved in establishment of planar polarity / ameboidal-type cell migration / interneuron migration /  1-alkyl-2-acetylglycerophosphocholine esterase complex / maintenance of centrosome location / microtubule sliding / platelet activating factor metabolic process / 1-alkyl-2-acetylglycerophosphocholine esterase complex / maintenance of centrosome location / microtubule sliding / platelet activating factor metabolic process /  acrosome assembly / radial glia-guided pyramidal neuron migration / microtubule organizing center organization / cerebral cortex neuron differentiation / positive regulation of intracellular transport / central region of growth cone / positive regulation of embryonic development / reelin-mediated signaling pathway / regulation of metaphase plate congression / establishment of centrosome localization / positive regulation of cytokine-mediated signaling pathway / cortical microtubule organization / establishment of spindle localization / astral microtubule / positive regulation of spindle assembly / layer formation in cerebral cortex / nuclear membrane disassembly / auditory receptor cell development / positive regulation of dendritic spine morphogenesis / vesicle transport along microtubule / stem cell division / stereocilium / myeloid leukocyte migration / acrosome assembly / radial glia-guided pyramidal neuron migration / microtubule organizing center organization / cerebral cortex neuron differentiation / positive regulation of intracellular transport / central region of growth cone / positive regulation of embryonic development / reelin-mediated signaling pathway / regulation of metaphase plate congression / establishment of centrosome localization / positive regulation of cytokine-mediated signaling pathway / cortical microtubule organization / establishment of spindle localization / astral microtubule / positive regulation of spindle assembly / layer formation in cerebral cortex / nuclear membrane disassembly / auditory receptor cell development / positive regulation of dendritic spine morphogenesis / vesicle transport along microtubule / stem cell division / stereocilium / myeloid leukocyte migration /  P-body assembly / P-body assembly /  dynein complex / COPI-independent Golgi-to-ER retrograde traffic / microtubule plus-end binding / minus-end-directed microtubule motor activity / dynein complex / COPI-independent Golgi-to-ER retrograde traffic / microtubule plus-end binding / minus-end-directed microtubule motor activity /  cytoplasmic dynein complex / retrograde axonal transport / negative regulation of JNK cascade / dynein light intermediate chain binding / brain morphogenesis / cytoplasmic dynein complex / retrograde axonal transport / negative regulation of JNK cascade / dynein light intermediate chain binding / brain morphogenesis /  繊毛 / nuclear migration / osteoclast development / microtubule associated complex / 繊毛 / nuclear migration / osteoclast development / microtubule associated complex /  kinesin complex / dynein intermediate chain binding / dynein complex binding / cochlea development / transmission of nerve impulse / cell leading edge / germ cell development / kinesin complex / dynein intermediate chain binding / dynein complex binding / cochlea development / transmission of nerve impulse / cell leading edge / germ cell development /  dynactin binding / establishment of mitotic spindle orientation / dynactin binding / establishment of mitotic spindle orientation /  phospholipase binding / neuromuscular process controlling balance / neuroblast proliferation / phospholipase binding / neuromuscular process controlling balance / neuroblast proliferation /  protein secretion / positive regulation of axon extension / Amplification of signal from unattached kinetochores via a MAD2 inhibitory signal / cytoplasmic microtubule / microtubule-based process / COPI-mediated anterograde transport / lipid catabolic process / regulation of microtubule cytoskeleton organization / cytoplasmic microtubule organization / protein secretion / positive regulation of axon extension / Amplification of signal from unattached kinetochores via a MAD2 inhibitory signal / cytoplasmic microtubule / microtubule-based process / COPI-mediated anterograde transport / lipid catabolic process / regulation of microtubule cytoskeleton organization / cytoplasmic microtubule organization /  stress granule assembly / Mitotic Prometaphase / EML4 and NUDC in mitotic spindle formation / regulation of mitotic spindle organization / axon cytoplasm / JNK cascade / Loss of Nlp from mitotic centrosomes / Loss of proteins required for interphase microtubule organization from the centrosome / Recruitment of mitotic centrosome proteins and complexes / Resolution of Sister Chromatid Cohesion / Recruitment of NuMA to mitotic centrosomes / HSP90 chaperone cycle for steroid hormone receptors (SHR) in the presence of ligand / Anchoring of the basal body to the plasma membrane / MHC class II antigen presentation / positive regulation of mitotic cell cycle / adult locomotory behavior / AURKA Activation by TPX2 / mitotic spindle organization / stress granule assembly / Mitotic Prometaphase / EML4 and NUDC in mitotic spindle formation / regulation of mitotic spindle organization / axon cytoplasm / JNK cascade / Loss of Nlp from mitotic centrosomes / Loss of proteins required for interphase microtubule organization from the centrosome / Recruitment of mitotic centrosome proteins and complexes / Resolution of Sister Chromatid Cohesion / Recruitment of NuMA to mitotic centrosomes / HSP90 chaperone cycle for steroid hormone receptors (SHR) in the presence of ligand / Anchoring of the basal body to the plasma membrane / MHC class II antigen presentation / positive regulation of mitotic cell cycle / adult locomotory behavior / AURKA Activation by TPX2 / mitotic spindle organization /  filopodium / RHO GTPases Activate Formins / hippocampus development / filopodium / RHO GTPases Activate Formins / hippocampus development /  phosphoprotein binding / phosphoprotein binding /  neuron migration / modulation of chemical synaptic transmission / Schaffer collateral - CA1 synapse / neuron migration / modulation of chemical synaptic transmission / Schaffer collateral - CA1 synapse /  動原体 / microtubule cytoskeleton organization / cerebral cortex development / Aggrephagy / HCMV Early Events / Separation of Sister Chromatids / azurophil granule lumen / 動原体 / microtubule cytoskeleton organization / cerebral cortex development / Aggrephagy / HCMV Early Events / Separation of Sister Chromatids / azurophil granule lumen /  Regulation of PLK1 Activity at G2/M Transition Regulation of PLK1 Activity at G2/M Transition類似検索 - 分子機能 | |||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.97 Å クライオ電子顕微鏡法 / 解像度: 3.97 Å | |||||||||
 データ登録者 データ登録者 | Reimer JM / DeSantis M / Reck-Peterson SL / Leschziner AE | |||||||||
| 資金援助 |  米国, 2件 米国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Elife / 年: 2023 ジャーナル: Elife / 年: 2023タイトル: Structures of human dynein in complex with the lissencephaly 1 protein, LIS1. 著者: Janice M Reimer / Morgan E DeSantis / Samara L Reck-Peterson / Andres E Leschziner /  要旨: The lissencephaly 1 protein, LIS1, is mutated in type-1 lissencephaly and is a key regulator of cytoplasmic dynein-1. At a molecular level, current models propose that LIS1 activates dynein by ...The lissencephaly 1 protein, LIS1, is mutated in type-1 lissencephaly and is a key regulator of cytoplasmic dynein-1. At a molecular level, current models propose that LIS1 activates dynein by relieving its autoinhibited form. Previously we reported a 3.1 Å structure of yeast dynein bound to Pac1, the yeast homologue of LIS1, which revealed the details of their interactions (Gillies et al., 2022). Based on this structure, we made mutations that disrupted these interactions and showed that they were required for dynein's function in vivo in yeast. We also used our yeast dynein-Pac1 structure to design mutations in human dynein to probe the role of LIS1 in promoting the assembly of active dynein complexes. These mutations had relatively mild effects on dynein activation, suggesting that there may be differences in how dynein and Pac1/LIS1 interact between yeast and humans. Here, we report cryo-EM structures of human dynein-LIS1 complexes. Our new structures reveal the differences between the yeast and human systems, provide a blueprint to disrupt the human dynein-LIS1 interactions more accurately, and map type-1 lissencephaly disease mutations, as well as mutations in dynein linked to malformations of cortical development/intellectual disability, in the context of the dynein-LIS1 complex. #1:  ジャーナル: Elife / 年: 2022 ジャーナル: Elife / 年: 2022タイトル: Structural basis for cytoplasmic dynein-1 regulation by Lis1. 著者: Gillies JP / Reimer JM / Karasmanis EP / Lahiri I / Htet ZM / Leschziner AE / Reck-Peterson SL | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_27783.map.gz emd_27783.map.gz | 157.3 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-27783-v30.xml emd-27783-v30.xml emd-27783.xml emd-27783.xml | 19.9 KB 19.9 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_27783_fsc.xml emd_27783_fsc.xml | 11.6 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_27783.png emd_27783.png | 45.5 KB | ||
| その他 |  emd_27783_half_map_1.map.gz emd_27783_half_map_1.map.gz emd_27783_half_map_2.map.gz emd_27783_half_map_2.map.gz | 154.4 MB 154.4 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-27783 http://ftp.pdbj.org/pub/emdb/structures/EMD-27783 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-27783 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-27783 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8dyvMC  8dyuC C: 同じ文献を引用 ( M: このマップから作成された原子モデル |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_27783.map.gz / 形式: CCP4 / 大きさ: 166.4 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_27783.map.gz / 形式: CCP4 / 大きさ: 166.4 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ボクセルのサイズ | X=Y=Z: 1.16 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #2
| ファイル | emd_27783_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
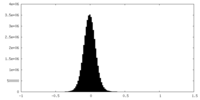
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_27783_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
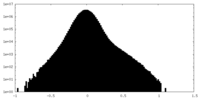
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Human cytoplasmic dynein-1 bound to one Lis1
| 全体 | 名称: Human cytoplasmic dynein-1 bound to one Lis1 |
|---|---|
| 要素 |
|
-超分子 #1: Human cytoplasmic dynein-1 bound to one Lis1
| 超分子 | 名称: Human cytoplasmic dynein-1 bound to one Lis1 / タイプ: complex / ID: 1 / キメラ: Yes / 親要素: 0 / 含まれる分子: #1-#2 |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Cytoplasmic dynein 1 heavy chain 1
| 分子 | 名称: Cytoplasmic dynein 1 heavy chain 1 / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 380.953594 KDa |
| 組換発現 | 生物種:   Spodoptera frugiperda (ツマジロクサヨトウ) Spodoptera frugiperda (ツマジロクサヨトウ) |
| 配列 | 文字列: GQVALEELQD LKGVWSELSK VWEQIDQMKE QPWVSVQPRK LRQNLDALLN QLKSFPARLR QYASYEFVQR LLKGYMKINM LVIELKSEA LKDRHWKQLM KRLHVNWVVS ELTLGQIWDV DLQKNEAIVK DVLLVAQGEM ALEEFLKQIR EVWNTYELDL V NYQNKCRL ...文字列: GQVALEELQD LKGVWSELSK VWEQIDQMKE QPWVSVQPRK LRQNLDALLN QLKSFPARLR QYASYEFVQR LLKGYMKINM LVIELKSEA LKDRHWKQLM KRLHVNWVVS ELTLGQIWDV DLQKNEAIVK DVLLVAQGEM ALEEFLKQIR EVWNTYELDL V NYQNKCRL IRGWDDLFNK VKEHINSVSA MKLSPYYKVF EEDALSWEDK LNRIMALFDV WIDVQRRWVY LEGIFTGSAD IK HLLPVET QRFQSISTEF LALMKKVSKS PLVMDVLNIQ GVQRSLERLA DLLGKIQKAL GEYLERERSS FPRFYFVGDE DLL EIIGNS KNVAKLQKHF KKMFAGVSSI ILNEDNSVVL GISSREGEEV MFKTPVSITE HPKINEWLTL VEKEMRVTLA KLLA ESVTE VEIFGKATSI DPNTYITWID KYQAQLVVLS AQIAWSENVE TALSSMGGGG DAAPLHSVLS NVEVTLNVLA DSVLM EQPP LRRRKLEHLI TELVHQRDVT RSLIKSKIDN AKSFEWLSQM RFYFDPKQTD VLQQLSIQMA NAKFNYGFEY LGVQDK LVQ TPLTDRCYLT MTQALEARLG GSPFGPAGTG KTESVKALGH QLGRFVLVFN CDETFDFQAM GRIFVGLCQV GAWGCFD EF NRLEERMLSA VSQQVQCIQE ALREHSNPNY DKTSAPITCE LLNKQVKVSP DMAIFITMNP GYAGRSNLPD NLKKLFRS L AMTKPDRQLI AQVMLYSQGF RTAEVLANKI VPFFKLCDEQ LSSQSHYDFG LRALKSVLVS AGNVKRERIQ KIKREKEER GEAVDEGEIA ENLPEQEILI QSVCETMVPK LVAEDIPLLF SLLSDVFPGV QYHRGEMTAL REELKKVCQE MYLTYGDGEE VGGMWVEKV LQLYQITQIN HGLMMVGPSG SGKSMAWRVL LKALERLEGV EGVAHIIDPK AISKDHLYGT LDPNTREWTD G LFTHVLRK IIDSVRGELQ KRQWIVFDGD VDPEWVENLN SVLDDNKLLT LPNGERLSLP PNVRIMFEVQ DLKYATLATV SR CGMVWFS EDVLSTDMIF NNFLARLRSI PLDEGEDEAQ RRRKGKEDEG EEAASPMLQI QRDAATIMQP YFTSNGLVTK ALE HAFQLE HIMDLTRLRC LGSLFSMLHQ ACRNVAQYNA NHPDFPMQIE QLERYIQRYL VYAILWSLSG DSRLKMRAEL GEYI RRITT VPLPTAPNIP IIDYEVSISG EWSPWQAKVP QIEVETHKVA APDVVVPTLD TVRHEALLYT WLAEHKPLVL CGPPG SGKT MTLFSALRAL PDMEVVGLNF SSATTPELLL KTFDHYCEYR RTPNGVVLAP VQLGKWLVLF CDEINLPDMD KYGTQR VIS FIRQMVEHGG FYRTSDQTWV KLERIQFVGA CNPPTDPGRK PLSHRFLRHV PVVYVDYPGP ASLTQIYGTF NRAMLRL IP SLRTYAEPLT AAMVEFYTMS QERFTQDTQP HYIYSPREMT RWVRGIFEAL RPLETLPVEG LIRIWAHEAL RLFQDRLV E DEERRWTDEN IDTVALKHFP NIDREKAMSR PILYSNWLSK DYIPVDQEEL RDYVKARLKV FYEEELDVPL VLFNEVLDH VLRIDRIFRQ PQGHLLLIGV SGAGKTTLSR FVAWMNGLSV YQIKVHRKYT GEDFDEDLRT VLRRSGCKNE KIAFIMDESN VLDSGFLER MNTLLANGEV PGLFEGDEYA TLMTQCKEGA QKEGLMLDSH EELYKWFTSQ VIRNLHVVFT MNPSSEGLKD R AATSPALF NRCVLNWFGD WSTEALYQVG KEFTSKMDLE KPNYIVPDYM PVVYDKLPQP PSHREAIVNS CVFVHQTLHQ AN ARLAKRG GRTMAITPRH YLDFINHYAN LFHEKRSELE EQQMHLNVGL RKIKETVDQV EELRRDLRIK SQELEVKNAA AND KLKKMV KDQQEAEKKK VMSQEIQEQL HKQQEVIADK QMSVKEDLDK VEPAVIEAQN AVKSIKKQHL VEVRSMANPP AAVK LALES ICLLLGESTT DWKQIRSIIM RENFIPTIVN FSAEEISDAI REKMKKNYMS NPSYNYEIVN RASLACGPMV KWAIA QLNY ADMLKRVEPL RNELQKLEDD AKDNQQKANE VEQMIRDLEA SIARYKEEYA VLISEAQAIK ADLAAVEAKV NRSTAL LKS LSAERERWEK TSETFKNQMS TIAGDCLLSA AFIAYAGYFD QQMRQNLFTT WSHHLQQANI QFRTDIARTE YLSNADE RL RWQASSLPAD DLCTENAIML KRFNRYPLII DPSGQATEFI MNEYKDRKIT RTSFLDDAFR KNLESALRFG NPLLVQDV E SYDPVLNPVL NREVRRTGGR VLITLGDQDI DLSPSFVIFL STRDPTVEFP PDLCSRVTFV NFTVTRSSLQ SQCLNEVLK AERPDVDEKR SDLLKLQGEF QLRLRQLEKS LLQALNEVKG RILDDDTIIT TLENLKREAA EVTRKVEETD IVMQEVETVS QQYLPLSTA CSSIYFTMES LKQIHFLYQY SLQFFLDIYH NVLYENPNLK GVTDHTQRLS IITKDLFQVA FNRVARGMLH Q DHITFAML LARIKLKGTV GEPTYDAEFQ HFLRGNEIVL SAGSTPRIQG LTVEQAEAVV RLSCLPAFKD LIAKVQADEQ FG IWLDSSS PEQTVPYLWS EETPATPIGQ AIHRLLLIQA FRPDRLLAMA HMFVSTNLGE SFMSIMEQPL DLTHIVGTEV KPN TPVLMC SVPGYDASGH VEDLAAEQNT QITSIAIGSA EGFNQADKAI NTAVKSGRWV MLKNVHLAPG WLMQLEKKLH SLQP HACFR LFLTMEINPK VPVNLLRAGR IFVFEPPPGV KANMLRTFSS IPVSRICKSP NERARLYFLL AWFHAIIQER LRYAP LGWS KKYEFGESDL RSACDTVDTW LDDTAKGRQN ISPDKIPWSA LKTLMAQSIY GGRVDNEFDQ RLLNTFLERL FTTRSF DSE FKLACKVDGH KDIQMPDGIR REEFVQWVEL LPDTQTPSWL GLPNNAERVL LTTQGVDMIS KMLKMQMLED EDDLAYA ET EKKTRTDSTS DGRPAWMRTL HTTASNWLHL IPQTLSHLKR TVENIKDPLF RFFEREVKMG AKLLQDVRQD LADVVQVC E GKKKQTNYLR TLINELVKGI LPRSWSHYTV PAGMTVIQWV SDFSERIKQL QNISLAAASG GAKELKNIHV CLGGLFVPE AYITATRQYV AQANSWSLEE LCLEVNVTTS QGATLDACSF GVTGLKLQGA TCNNNKLSLS NAISTALPLT QLRWVKQTNT EKKASVVTL PVYLNFTRAD LIFTVDFEIA TKEDPRSFYE RGVAVLCTE |
-分子 #2: Platelet-activating factor acetylhydrolase IB subunit beta
| 分子 | 名称: Platelet-activating factor acetylhydrolase IB subunit beta タイプ: protein_or_peptide / ID: 2 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 46.722918 KDa |
| 組換発現 | 生物種:   Spodoptera frugiperda (ツマジロクサヨトウ) Spodoptera frugiperda (ツマジロクサヨトウ) |
| 配列 | 文字列: GSVLSQRQRD ELNRAIADYL RSNGYEEAYS VFKKEAELDV NEELDKKYAG LLEKKWTSVI RLQKKVMELE SKLNEAKEEF TSGGPLGQK RDPKEWIPRP PEKYALSGHR SPVTRVIFHP VFSVMVSASE DATIKVWDYE TGDFERTLKG HTDSVQDISF D HSGKLLAS ...文字列: GSVLSQRQRD ELNRAIADYL RSNGYEEAYS VFKKEAELDV NEELDKKYAG LLEKKWTSVI RLQKKVMELE SKLNEAKEEF TSGGPLGQK RDPKEWIPRP PEKYALSGHR SPVTRVIFHP VFSVMVSASE DATIKVWDYE TGDFERTLKG HTDSVQDISF D HSGKLLAS CSADMTIKLW DFQGFECIRT MHGHDHNVSS VAIMPNGDHI VSASRDKTIK MWEVQTGYCV KTFTGHREWV RM VRPNQDG TLIASCSNDQ TVRVWVVATK ECKAELREHE HVVECISWAP ESSYSSISEA TGSETKKSGK PGPFLLSGSR DKT IKMWDV STGMCLMTLV GHDNWVRGVL FHSGGKFILS CADDKTLRVW DYKNKRCMKT LNAHEHFVTS LDFHKTAPYV VTGS VDQTV KVWECR |
-分子 #3: ADENOSINE-5'-DIPHOSPHATE
| 分子 | 名称: ADENOSINE-5'-DIPHOSPHATE / タイプ: ligand / ID: 3 / コピー数: 3 / 式: ADP |
|---|---|
| 分子量 | 理論値: 427.201 Da |
| Chemical component information | 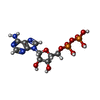 ChemComp-ADP: |
-分子 #4: ADENOSINE-5'-TRIPHOSPHATE
| 分子 | 名称: ADENOSINE-5'-TRIPHOSPHATE / タイプ: ligand / ID: 4 / コピー数: 1 / 式: ATP |
|---|---|
| 分子量 | 理論値: 507.181 Da |
| Chemical component information | 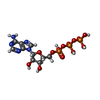 ChemComp-ATP: |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.4 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TALOS ARCTICA |
|---|---|
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / 最大 デフォーカス(公称値): 2.2 µm Bright-field microscopy / 最大 デフォーカス(公称値): 2.2 µm最小 デフォーカス(公称値): 1.4000000000000001 µm |
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 平均電子線量: 55.0 e/Å2 |
| 実験機器 |  モデル: Talos Arctica / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー
























 Z
Z Y
Y X
X