+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Leishmania major actin filament in ADP-Pi state | |||||||||
 マップデータ マップデータ | Real-space symmetrized and Phenix autosharpened map | |||||||||
 試料 試料 |
| |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報 | |||||||||
| 生物種 |   Leishmania major (大形リーシュマニア) Leishmania major (大形リーシュマニア) | |||||||||
| 手法 | らせん対称体再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.3 Å クライオ電子顕微鏡法 / 解像度: 3.3 Å | |||||||||
 データ登録者 データ登録者 | Kotila T / Muniyandi S / Lappalainen P / Huiskonen JT | |||||||||
| 資金援助 |  フィンランド, 2件 フィンランド, 2件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2022 ジャーナル: Nat Commun / 年: 2022タイトル: Structural basis of rapid actin dynamics in the evolutionarily divergent Leishmania parasite. 著者: Tommi Kotila / Hugo Wioland / Muniyandi Selvaraj / Konstantin Kogan / Lina Antenucci / Antoine Jégou / Juha T Huiskonen / Guillaume Romet-Lemonne / Pekka Lappalainen /   要旨: Actin polymerization generates forces for cellular processes throughout the eukaryotic kingdom, but our understanding of the 'ancient' actin turnover machineries is limited. We show that, ...Actin polymerization generates forces for cellular processes throughout the eukaryotic kingdom, but our understanding of the 'ancient' actin turnover machineries is limited. We show that, despite > 1 billion years of evolution, pathogenic Leishmania major parasite and mammalian actins share the same overall fold and co-polymerize with each other. Interestingly, Leishmania harbors a simple actin-regulatory machinery that lacks cofilin 'cofactors', which accelerate filament disassembly in higher eukaryotes. By applying single-filament biochemistry we discovered that, compared to mammalian proteins, Leishmania actin filaments depolymerize more rapidly from both ends, and are severed > 100-fold more efficiently by cofilin. Our high-resolution cryo-EM structures of Leishmania ADP-, ADP-Pi- and cofilin-actin filaments identify specific features at actin subunit interfaces and cofilin-actin interactions that explain the unusually rapid dynamics of parasite actin filaments. Our findings reveal how divergent parasites achieve rapid actin dynamics using a remarkably simple set of actin-binding proteins, and elucidate evolution of the actin cytoskeleton. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_13863.map.gz emd_13863.map.gz | 54.1 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-13863-v30.xml emd-13863-v30.xml emd-13863.xml emd-13863.xml | 19.7 KB 19.7 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_13863_fsc.xml emd_13863_fsc.xml | 9.1 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_13863.png emd_13863.png | 98.9 KB | ||
| マスクデータ |  emd_13863_msk_1.map emd_13863_msk_1.map | 64 MB |  マスクマップ マスクマップ | |
| その他 |  emd_13863_additional_1.map.gz emd_13863_additional_1.map.gz emd_13863_half_map_1.map.gz emd_13863_half_map_1.map.gz emd_13863_half_map_2.map.gz emd_13863_half_map_2.map.gz | 59.7 MB 49.4 MB 49.4 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-13863 http://ftp.pdbj.org/pub/emdb/structures/EMD-13863 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-13863 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-13863 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_13863.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_13863.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Real-space symmetrized and Phenix autosharpened map | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.97 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_13863_msk_1.map emd_13863_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-追加マップ: Postprocess from Relion
| ファイル | emd_13863_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Postprocess from Relion | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Half-map 2
| ファイル | emd_13863_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half-map 2 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Half-map 1
| ファイル | emd_13863_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half-map 1 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Polymerized actin
| 全体 | 名称: Polymerized actin |
|---|---|
| 要素 |
|
-超分子 #1: Polymerized actin
| 超分子 | 名称: Polymerized actin / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:   Leishmania major (大形リーシュマニア) Leishmania major (大形リーシュマニア) |
| 組換発現 | 生物種:   Spodoptera frugiperda (ツマジロクサヨトウ) Spodoptera frugiperda (ツマジロクサヨトウ) |
-分子 #1: Actin
| 分子 | 名称: Actin / タイプ: protein_or_peptide / ID: 1 / コピー数: 5 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Leishmania major (大形リーシュマニア) Leishmania major (大形リーシュマニア) |
| 分子量 | 理論値: 42.063867 KDa |
| 組換発現 | 生物種:   Spodoptera frugiperda (ツマジロクサヨトウ) Spodoptera frugiperda (ツマジロクサヨトウ) |
| 配列 | 文字列: MADNEQSSIV CDNGSGMVKA GFSGDDAPRH VFPSIVGRPK NMQAMMGSAN KTVYVGDEAQ SKRGVLSLKY PIEHGIVTNW DDMEKIWHH TFYNELRVNP EQHNVLLTEA PMNPKQNREK MTQIMFETFN VPSLYIGIQA VLSLYSSGRT TGIVLDAGDG V THTVPIYE ...文字列: MADNEQSSIV CDNGSGMVKA GFSGDDAPRH VFPSIVGRPK NMQAMMGSAN KTVYVGDEAQ SKRGVLSLKY PIEHGIVTNW DDMEKIWHH TFYNELRVNP EQHNVLLTEA PMNPKQNREK MTQIMFETFN VPSLYIGIQA VLSLYSSGRT TGIVLDAGDG V THTVPIYE GYSLPHAVRR VDMAGRDLTE YLMKIMMETG TTFTTTAEKE IVRNVKEQLC YVALDFEEEM TNSAKSANEE AF ELPDGNV MMVGNQRFRC PEVLFKPSLI GLDEAPGFPE MVYQSINKCD IDVRRELYGN IVLSGGSTMF LNLPERLAKE ISN LAPSSI KPKVVAPPER KYSVWIGGSI LSSLTTFQTM WVKKSEYDES GPSIVHNKCF |
-分子 #2: MAGNESIUM ION
| 分子 | 名称: MAGNESIUM ION / タイプ: ligand / ID: 2 / コピー数: 5 / 式: MG |
|---|---|
| 分子量 | 理論値: 24.305 Da |
-分子 #3: ADENOSINE-5'-DIPHOSPHATE
| 分子 | 名称: ADENOSINE-5'-DIPHOSPHATE / タイプ: ligand / ID: 3 / コピー数: 5 / 式: ADP |
|---|---|
| 分子量 | 理論値: 427.201 Da |
| Chemical component information | 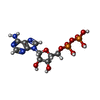 ChemComp-ADP: |
-分子 #4: PHOSPHATE ION
| 分子 | 名称: PHOSPHATE ION / タイプ: ligand / ID: 4 / コピー数: 5 / 式: PO4 |
|---|---|
| 分子量 | 理論値: 94.971 Da |
| Chemical component information | 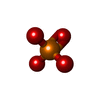 ChemComp-PO4: |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | らせん対称体再構成法 |
| 試料の集合状態 | filament |
- 試料調製
試料調製
| 濃度 | 0.5 mg/mL |
|---|---|
| 緩衝液 | pH: 7.2 詳細: Phosphate buffered saline supplemented with 0.2 mM ATP, 1 mM MgCl2, 0.4 mM EGTA and 1 mM DTT. |
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: COPPER / メッシュ: 300 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: GLOW DISCHARGE |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 95 % / チャンバー内温度: 279.15 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TALOS ARCTICA |
|---|---|
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / Cs: 2.7 mm Bright-field microscopy / Cs: 2.7 mm |
| 撮影 | フィルム・検出器のモデル: FEI FALCON II (4k x 4k) 実像数: 45 / 平均電子線量: 45.0 e/Å2 |
| 実験機器 |  モデル: Talos Arctica / 画像提供: FEI Company |
- 画像解析
画像解析
-原子モデル構築 1
| 精密化 | 空間: REAL |
|---|---|
| 得られたモデル |  PDB-7q8b: |
 ムービー
ムービー コントローラー
コントローラー











 X (Sec.)
X (Sec.) Y (Row.)
Y (Row.) Z (Col.)
Z (Col.)