+検索条件
-Structure paper
| タイトル | Structures of modified eEF2 80S ribosome complexes reveal the role of GTP hydrolysis in translocation. |
|---|---|
| ジャーナル・号・ページ | EMBO J, Vol. 26, Issue 9, Page 2421-2431, Year 2007 |
| 掲載日 | 2007年5月2日 |
 著者 著者 | Derek J Taylor / Jakob Nilsson / A Rod Merrill / Gregers Rom Andersen / Poul Nissen / Joachim Frank /  |
| PubMed 要旨 | On the basis of kinetic data on ribosome protein synthesis, the mechanical energy for translocation of the mRNA-tRNA complex is thought to be provided by GTP hydrolysis of an elongation factor (eEF2 ...On the basis of kinetic data on ribosome protein synthesis, the mechanical energy for translocation of the mRNA-tRNA complex is thought to be provided by GTP hydrolysis of an elongation factor (eEF2 in eukaryotes, EF-G in bacteria). We have obtained cryo-EM reconstructions of eukaryotic ribosomes complexed with ADP-ribosylated eEF2 (ADPR-eEF2), before and after GTP hydrolysis, providing a structural basis for analyzing the GTPase-coupled mechanism of translocation. Using the ADP-ribosyl group as a distinct marker, we observe conformational changes of ADPR-eEF2 that are due strictly to GTP hydrolysis. These movements are likely representative of native eEF2 motions in a physiological context and are sufficient to uncouple the mRNA-tRNA complex from two universally conserved bases in the ribosomal decoding center (A1492 and A1493 in Escherichia coli) during translocation. Interpretation of these data provides a detailed two-step model of translocation that begins with the eEF2/EF-G binding-induced ratcheting motion of the small ribosomal subunit. GTP hydrolysis then uncouples the mRNA-tRNA complex from the decoding center so translocation of the mRNA-tRNA moiety may be completed by a head rotation of the small subunit. |
 リンク リンク |  EMBO J / EMBO J /  PubMed:17446867 / PubMed:17446867 /  PubMed Central PubMed Central |
| 手法 | EM (単粒子) |
| 解像度 | 8.9 - 11.7 Å |
| 構造データ | EMDB-1342: Structures of modified eEF2 80S ribosome complexes reveal the role of GTP hydrolysis in translocation. EMDB-1343: Structures of modified eEF2 80S ribosome complexes reveal the role of GTP hydrolysis in translocation. |
| 化合物 | 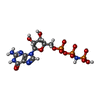 ChemComp-GNP: 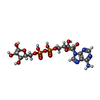 ChemComp-APR: 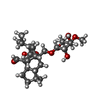 ChemComp-SO1: 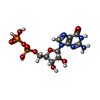 ChemComp-GDP: |
| 由来 |
|
 キーワード キーワード |  TRANSLATION (翻訳 (生物学)) / elongation / translocation / TRANSLATION (翻訳 (生物学)) / elongation / translocation /  GTPase (GTPアーゼ) / GTPase (GTPアーゼ) /  80S ribosome 80S ribosome |
 ムービー
ムービー コントローラー
コントローラー 構造ビューア
構造ビューア 万見文献について
万見文献について















